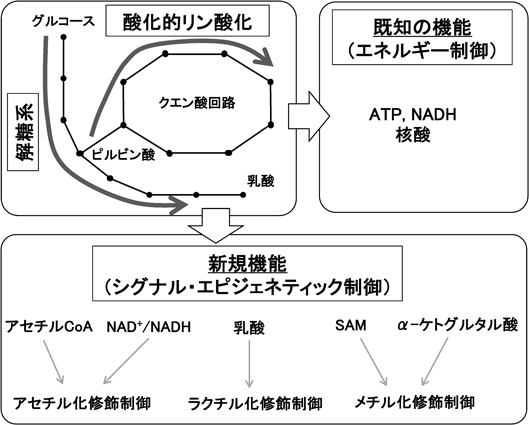
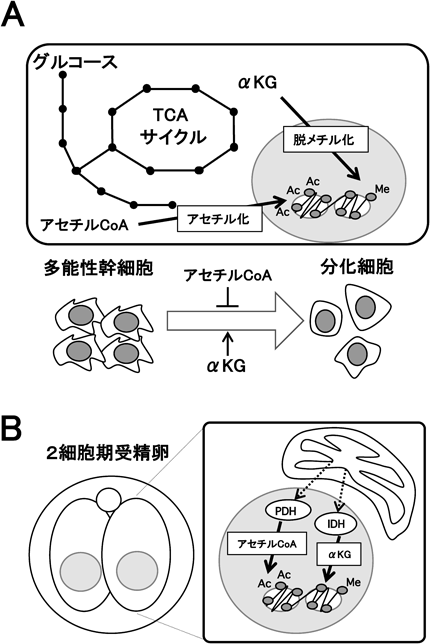
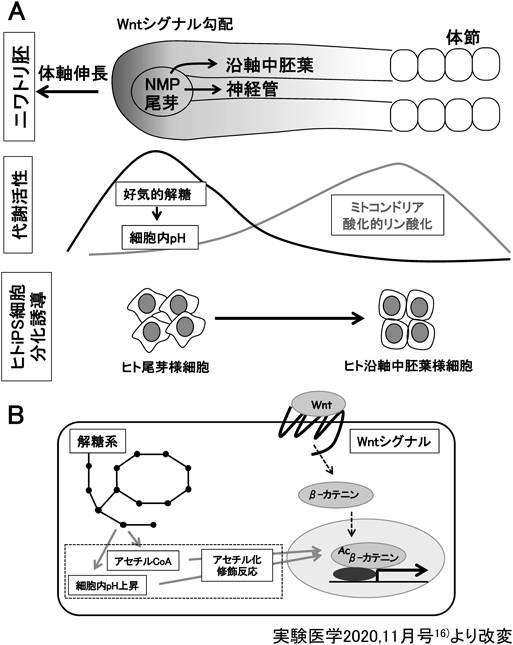
エネルギー代謝の驚くべき新機能:代謝物を介した胚発生制御Remarkable function of the energy metabolism: A novel player regulating embryonic development
大阪大学微生物病研究所Research Institute for Microbial Diseases, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘3番1号 ◇ 3–1 Yamadaoka, Suita, Osaka 565–0871, Japan