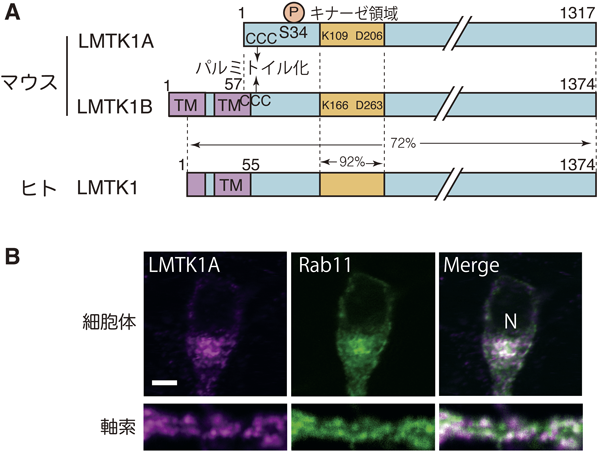
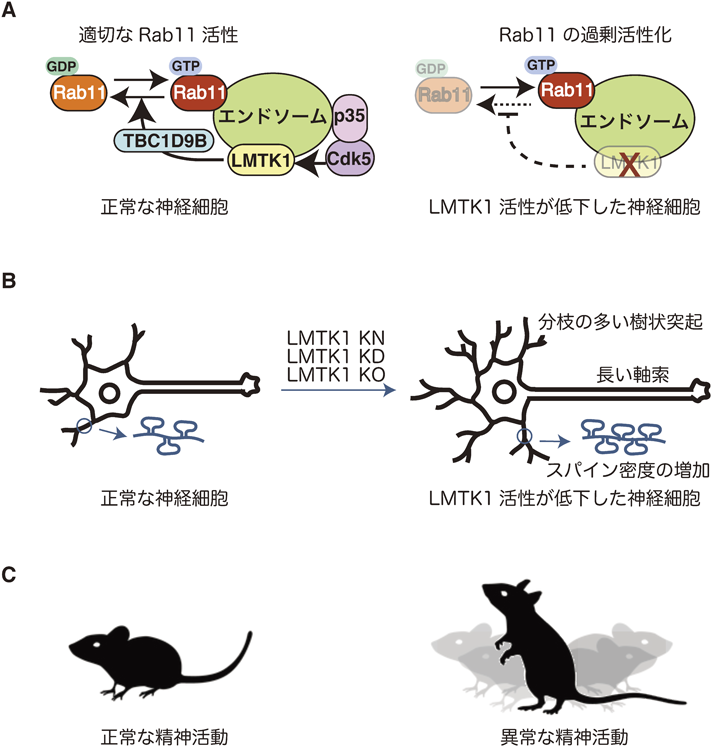
エンドソーム結合性プロテインキナーゼLMTK1によるRab11活性制御と神経機能LMTK1, endosome-associated Ser/Thr kinase regulating Rab11-dependent endosomal trafficking in neurons
1 東京都立大学Laboratory of Molecular Neuroscience, Department of Biological Sciences, Tokyo Metropolitan University ◇ 〒192–0397 東京都八王子市南大沢1–1 ◇ 1–1 Minami-osawa, Hachioji, Tokyo 192–0397, Japan
2 明海大学Department of Oral Health Sciences, Meikai University School of Health Sciences ◇ 〒279–8550 千葉県浦安市明海一丁目 ◇ 1-chome Meikai, Urayasu, Chiba 279–8550, Japan
3 東京都臨床医学総合研究所Department of Dementia and Higher Brain Function, Tokyo Metropolitan Institute of Medical Science ◇ 〒156–8506 東京都世田谷区上北沢2–1–6 ◇ 2–1–6 Kamikitazawa, Setagaya, Tokyo 156–8506, Japan