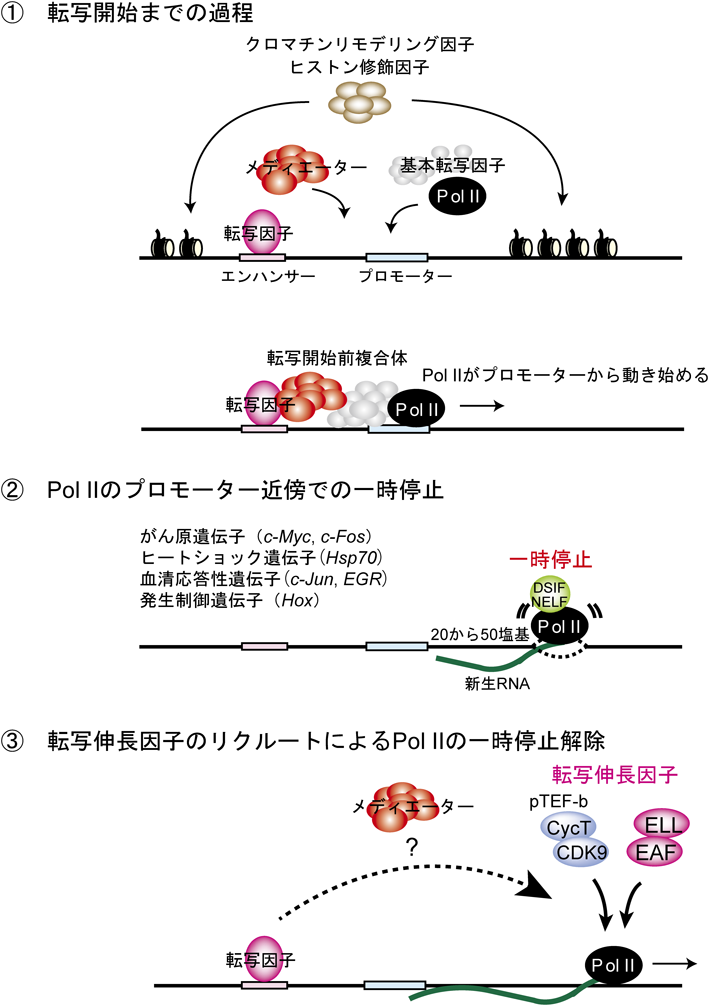
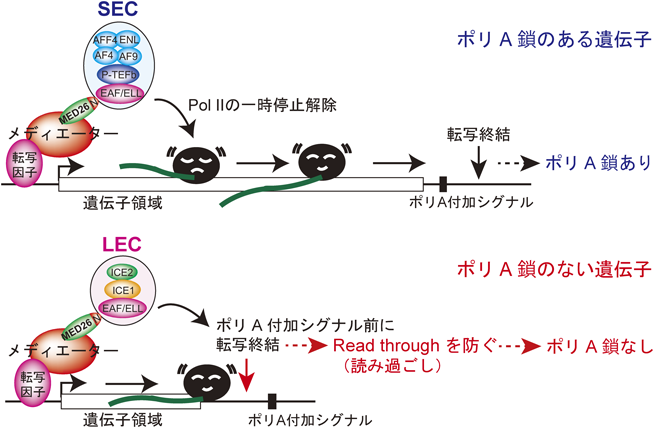
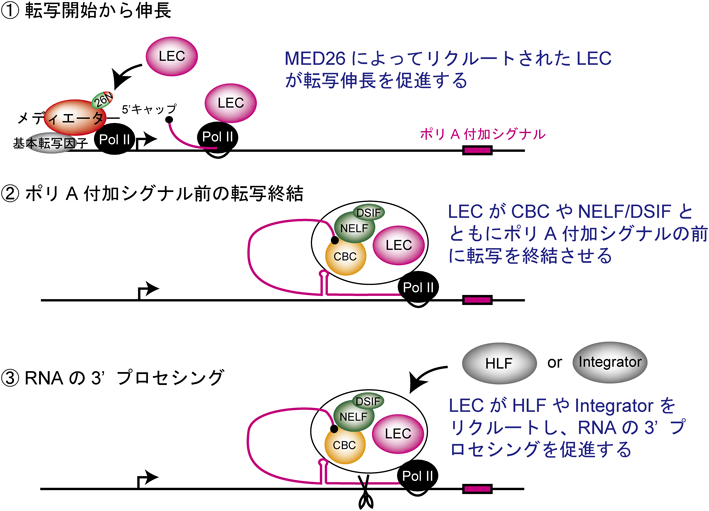
メディエーター複合体のコンポーネントMED26による新たな転写制御機構Novel mechanism of transcription regulation by human Mediator subunit MED26
横浜市立大学大学院医学研究科分子生物学分野Department of Molecular Biology, Yokohama City University Graduate School of Medical Science ◇ 〒236–0004 横浜市金沢区福浦3–9 ◇ 3–9 Fukuura, Kanazawa-ku, Yokohama, Kanagawa 236–0004, Japan