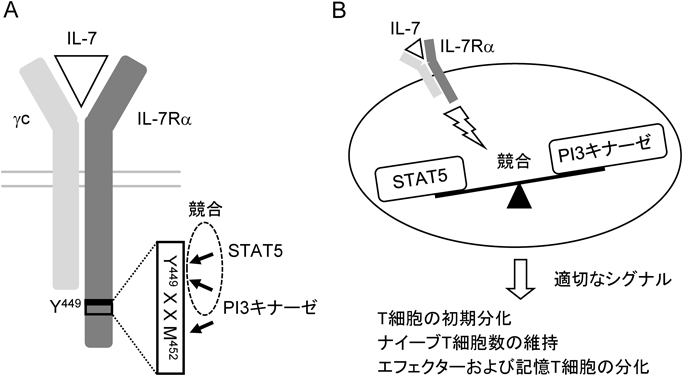
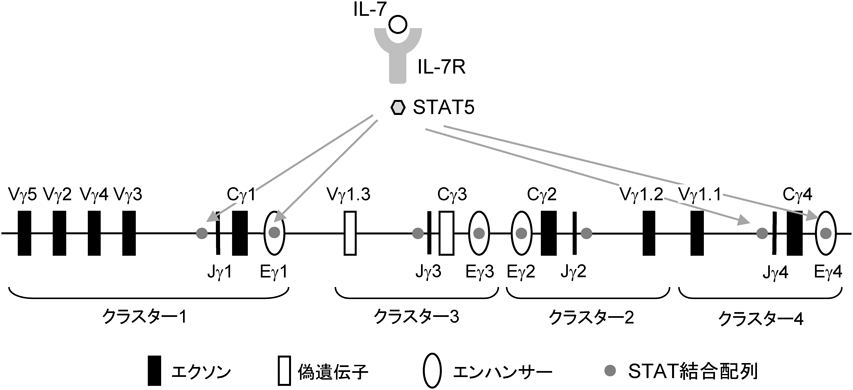
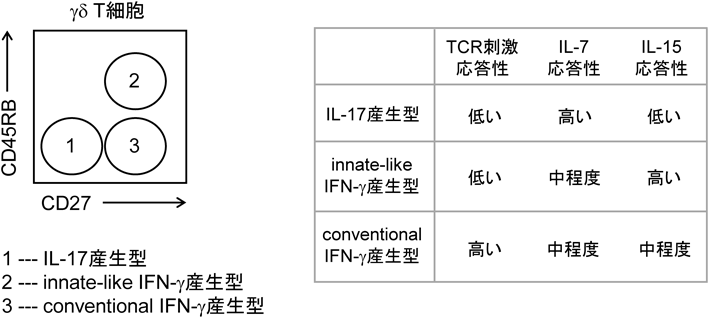
Tリンパ球の分化と機能におけるIL-7受容体シグナルの役割Roles of IL-7R signaling in differentiation and function of T lymphocytes
1 京都大学ウイルス・再生医科学研究所免疫制御分野Laboratory of Immune Regulation, Department of Virus Research, Institute for Frontier Life and Medical Sciences, Kyoto University ◇ 〒606–8507 京都市左京区聖護院川原町53 ◇ 53 Shogoin Kawahara-cho, Sakyo-ku, Kyoto 606–8507, Japan
2 京都大学医学研究科人間健康科学専攻Department of Human Health Sciences, Graduate School of Medicine, Kyoto University ◇ 〒606–8507 京都市左京区聖護院川原町53 ◇ 53 Shogoin Kawahara-cho, Sakyo-ku, Kyoto 606–8507, Japan