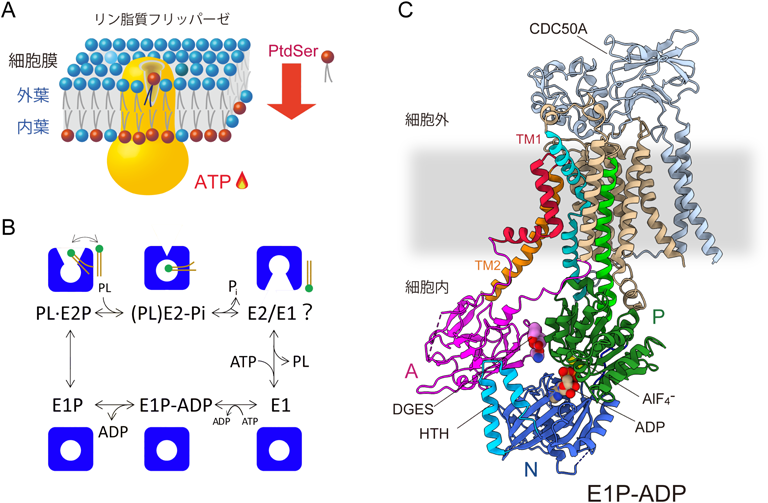
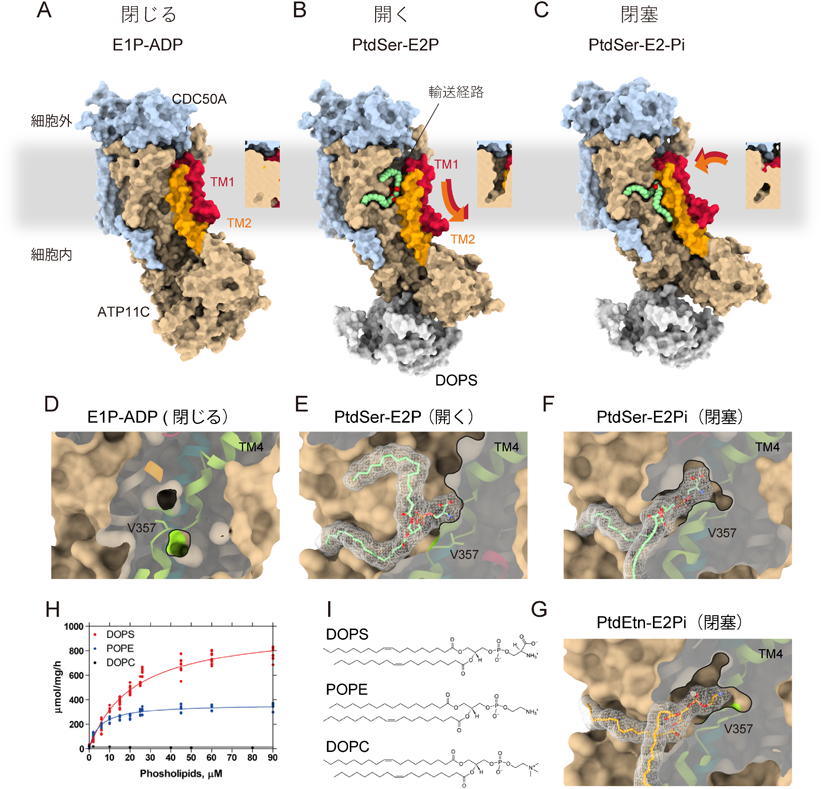
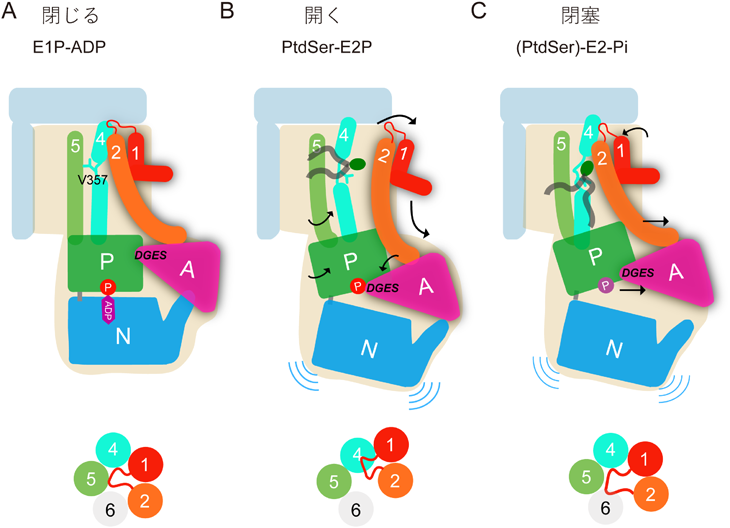
細胞膜リン脂質フリッパーゼATP11Cの立体構造と輸送機構Structures and transport mechanism of the plasma membrane flippase ATP11C
名古屋大学細胞生理学研究センターCellular and Structural Physiology Institute, Nagoya University ◇ 〒464–8601 名古屋市千種区不老町 ◇ Furo-cho, Chikusa-ku, Nagoya 464–8601, Japan