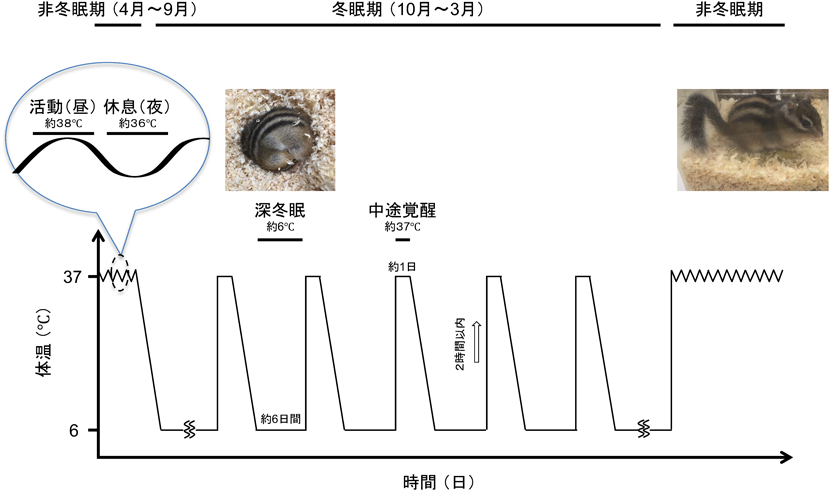
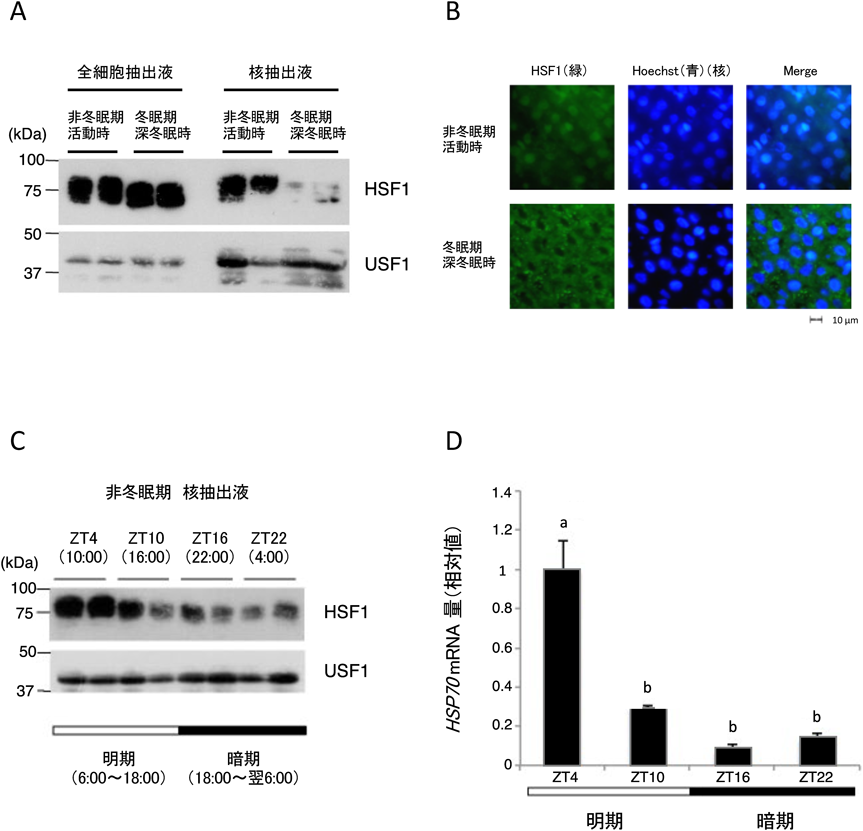
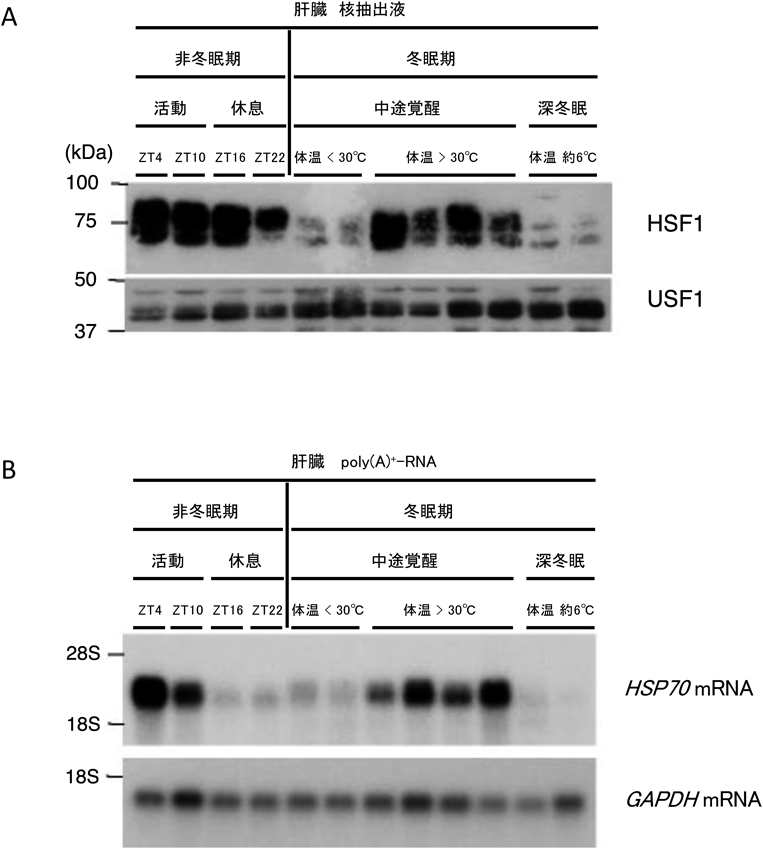
冬眠哺乳動物シマリスの体温変動を利用した冬眠期の遺伝子発現制御機構Gene expression regulation during hibernation using body temperature fluctuations in the mammalian hibernator chipmunk
北里大学理学部生物科学科分子生物学講座Laboratory of Molecular Biology, Department of Biosciences, School of Science, Kitasato University ◇ 〒252–0373 神奈川県相模原市南区北里一丁目15番1号 S号館201 ◇ S201, 1–15–1 Kitasato, Minami, Sagamihara, Kanagawa 252–0373, Japan