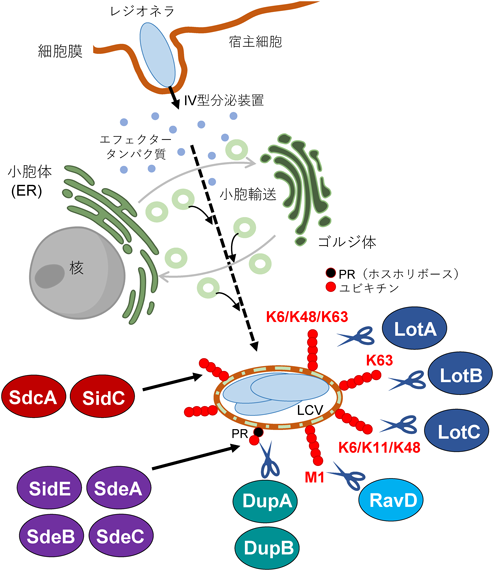
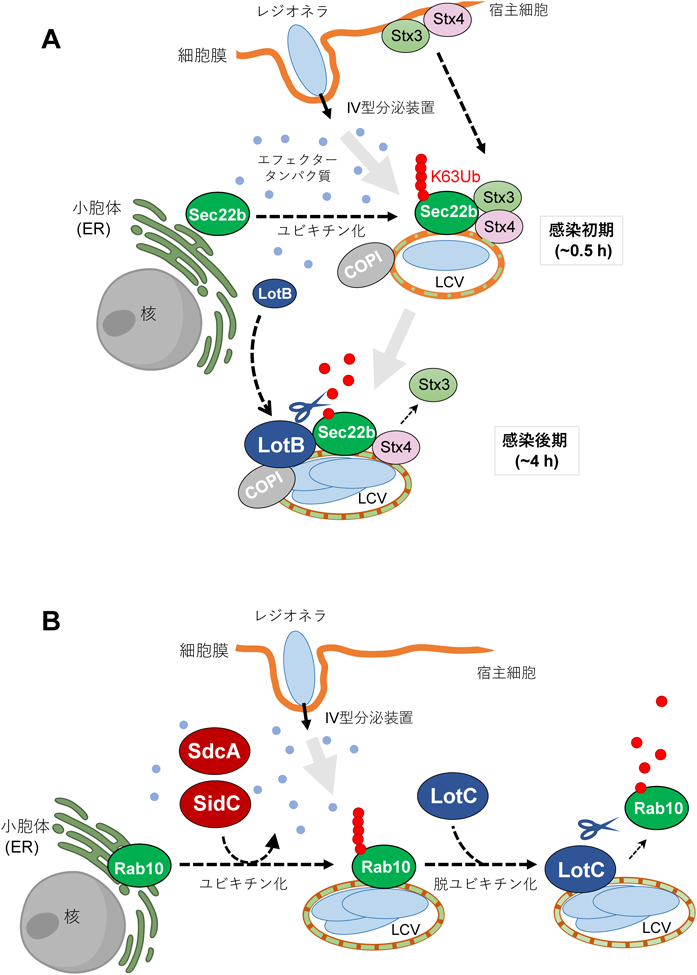
病原細菌レジオネラによるユビキチンを介した宿主小胞輸送システムの操作Ubiquitin-mediated manipulation of host vesicle trafficking by the intracellular bacterial pathogen Legionella pneumophila
岐阜大学大学院医学系研究科・病原体制御学分野Department of Microbiology, Graduate School of Medicine, Gifu University ◇ 〒501–1194 岐阜県岐阜市柳戸1–1 ◇ 1–1 Yanagito, Gifu 501–1194, Japan