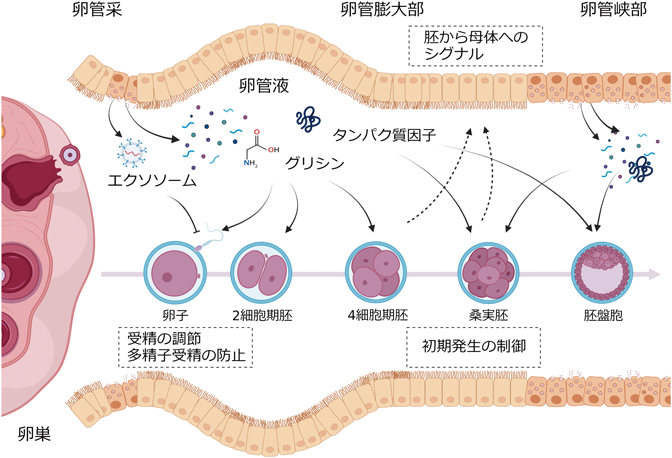
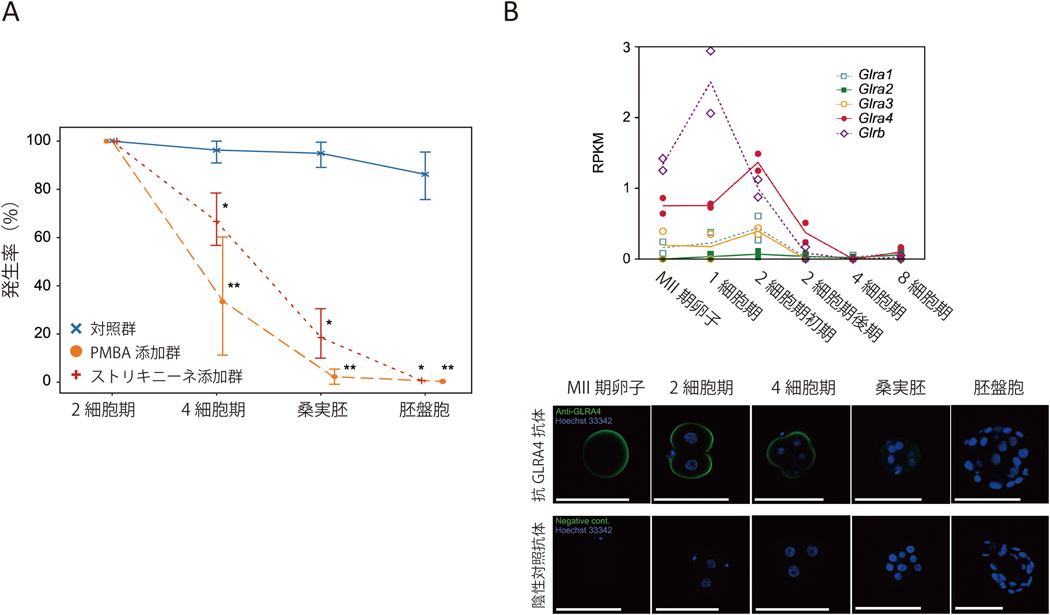
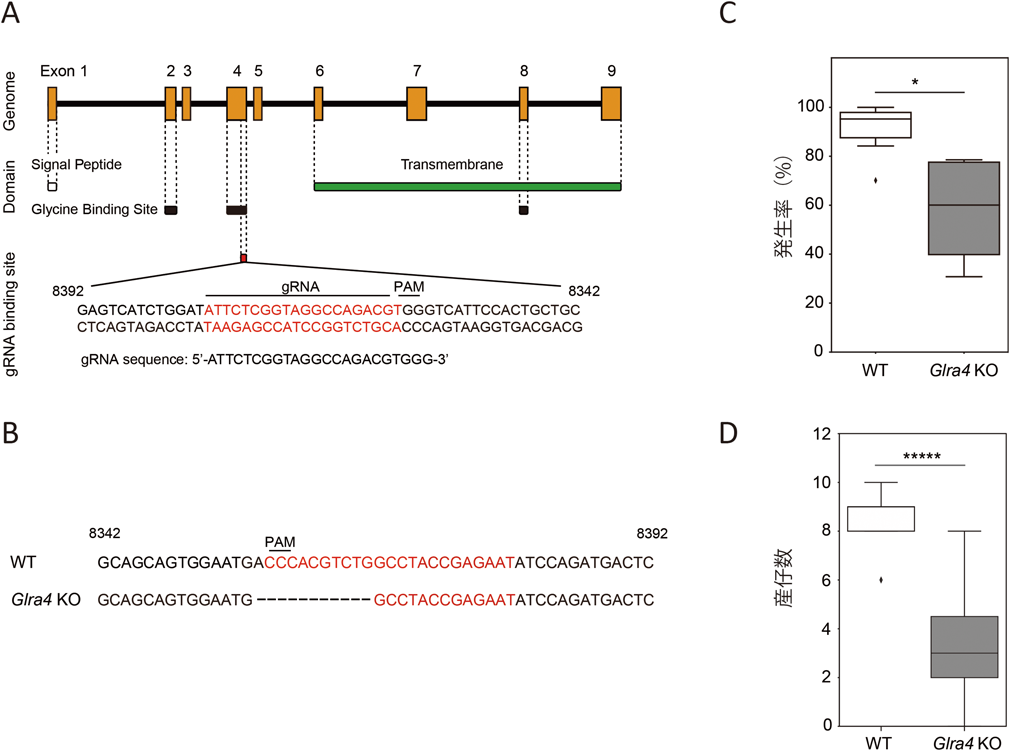
卵管液の生化学―母体と受精卵のクロストーク―Biochemistry of oviductal fluid: Crosstalk between maternal oviduct and embryos
金沢医科大学総合医学研究所Medical Research Institute, Kanazawa Medical University ◇ 〒920–0293 石川県河北郡内灘町大学1丁目1番地 ◇ 1–1 Daigaku, Uchinada, Kahoku, Ishikawa 920–0293, Japan