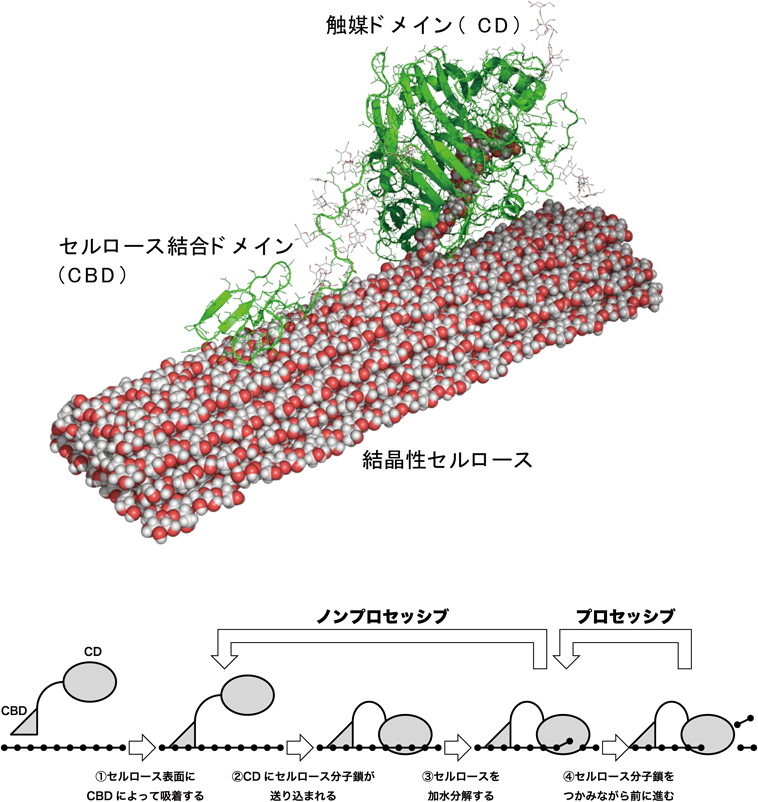
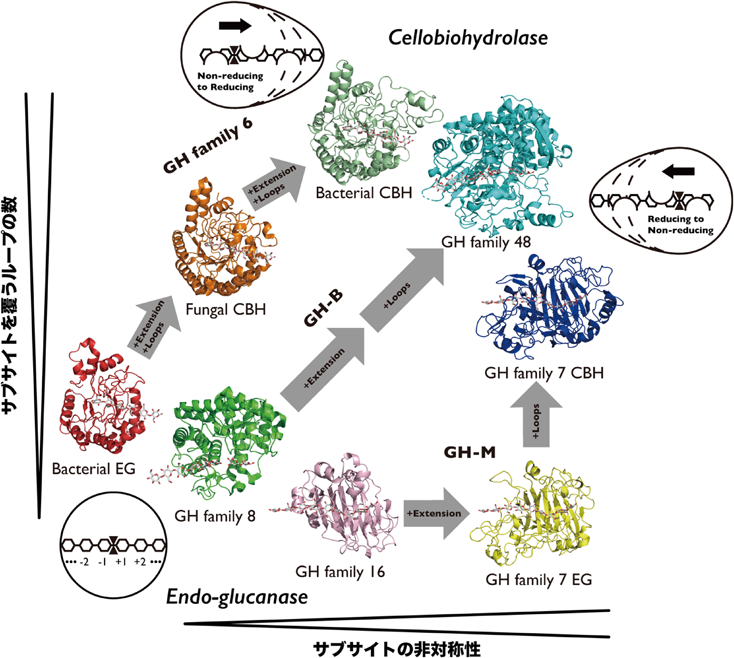
結晶性セルロースを分解するセルラーゼにおけるタンパク質レベルの収斂進化The protein level convergent evolution in cellulases degrading crystalline cellulose
五十嵐 圭日子,内山 拓*1Kiyohiko Igarashi, Taku Uchiyama*1
東京大学大学院農学生命科学研究科Department of Biomaterial Sciences, Graduate School of Agricultural and Life Sciences, The University of Tokyo ◇ 〒113–8657 東京都文京区弥生1–1–1 ◇ 1–1–1 Yayoi, Bunkyo-ku, Tokyo 113–8657, Japan
*1現所属:産業技術総合研究所生物プロセス研究部門生物システム研究グループ(〒305–8566 茨城県つくば市東1–1–1つくば中央第6)Present address: Bioproduction Research Institute, National Institute of Advanced Industrial Science and Technology, Tsukuba Central 6, 1–1–1 Higashi, Tsukuba, Ibaraki 305–8566, Japan
発行日:2021年12月25日Published: December 25, 2021