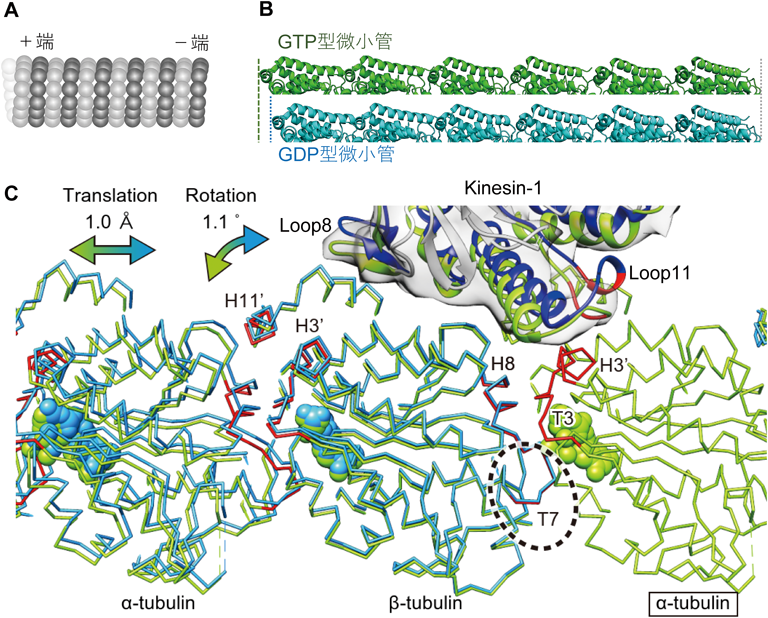
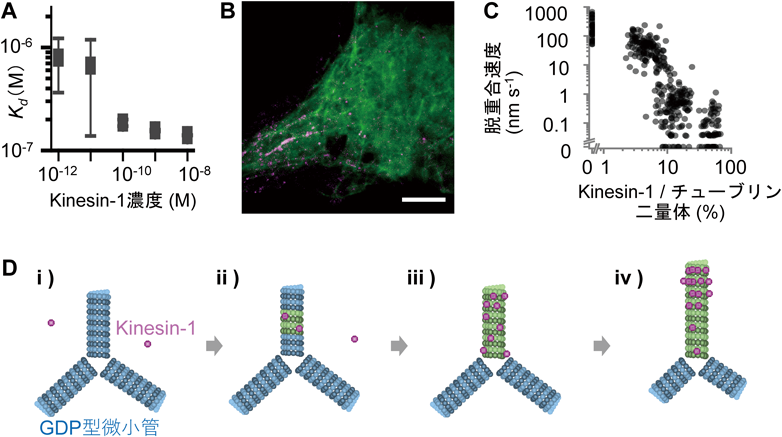
キネシンによる微小管の構造変化と細胞極性への影響Kinesin-triggered microtubule conformational changes as a key for cell polarity
東京大学大学院理学系研究科Graduate School of Science, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 理学部1号館 ◇ Hongo 7–3–1, Faculty of Science Building 1, Bunkyo-ku, Tokyo 113–0033, Japan