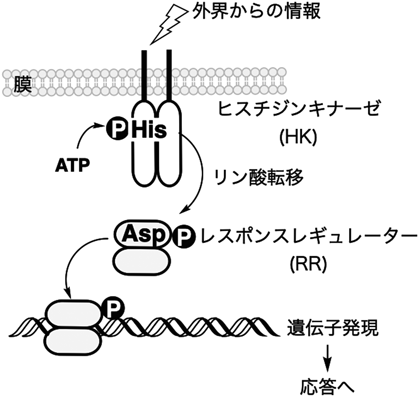
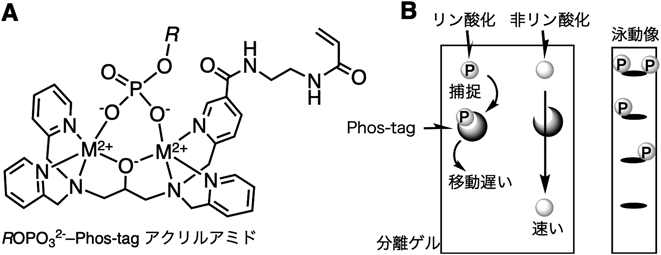
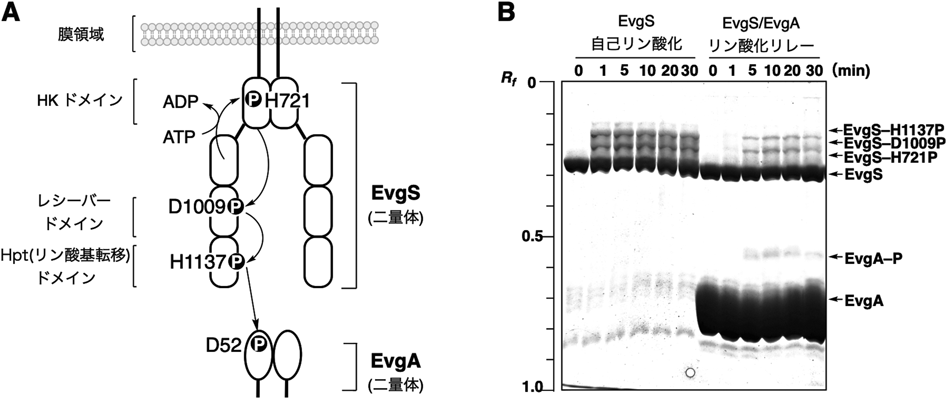
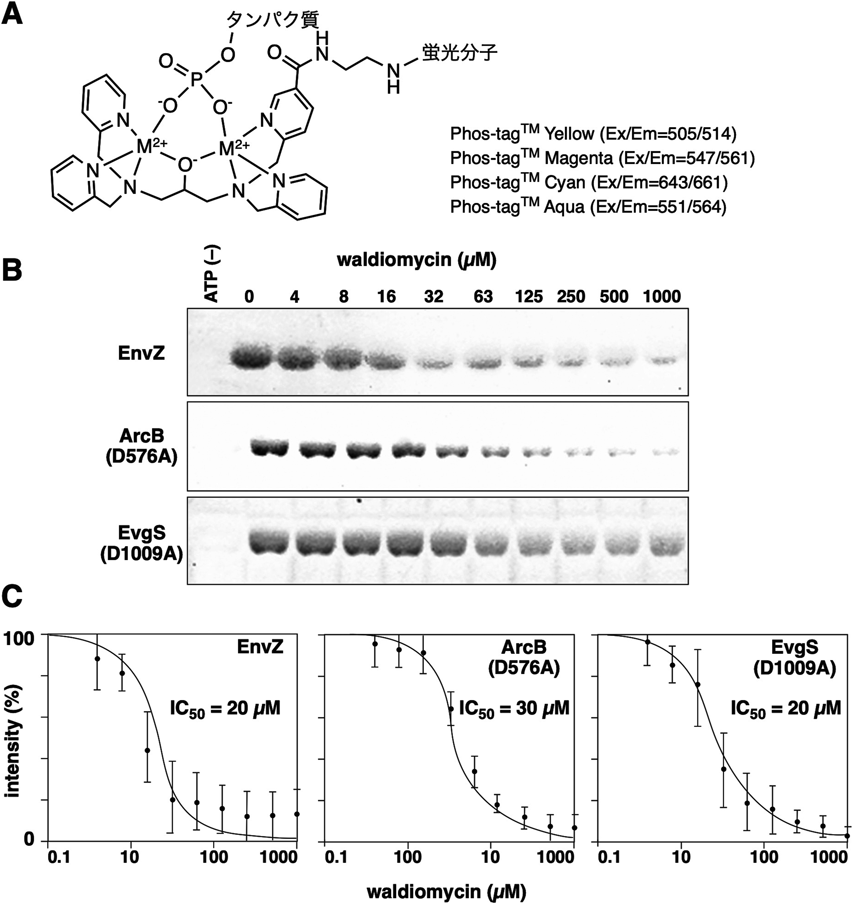
Phos-tagを用いた不安定なヒスチジンやアスパラギン酸のリン酸化タンパク質の解析Analysis of labile histidine and aspartic acid phosphorylated proteins using Phos-tag technologies
1 広島大学大学院医系科学研究科医薬分子機能科学研究室Department of Functional Molecular Science, Graduate School of Biomedical and Health Sciences, Hiroshima University ◇ 〒734–8551 広島市南区霞1–2–3 ◇ Kasumi 1–2–3, Hiroshima 734–8551, Japan
2 広島文教大学人間科学部人間栄養学科Department of Human Nutrition, Faculty of Human Sciences, Hiroshima Bunkyo University ◇ 〒731–0295 広島市安佐北区可部東1–2–3 ◇ Kabehigashi 1–2–1, Asakita-ku, Hiroshima 731–0295, Japan