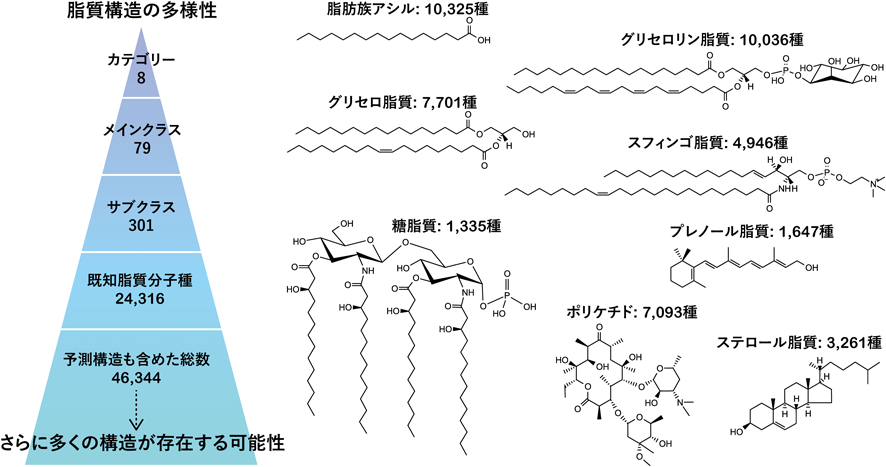
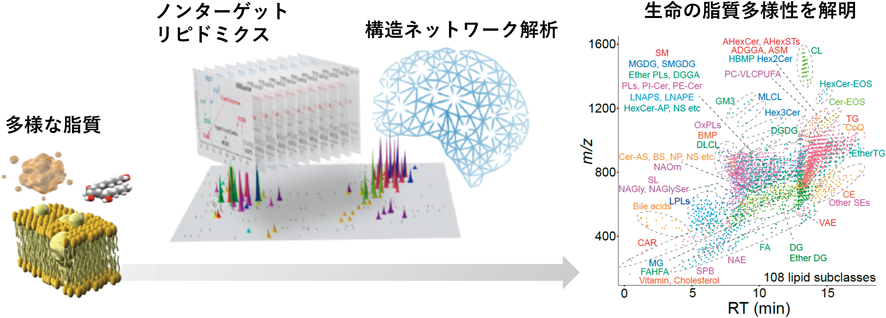
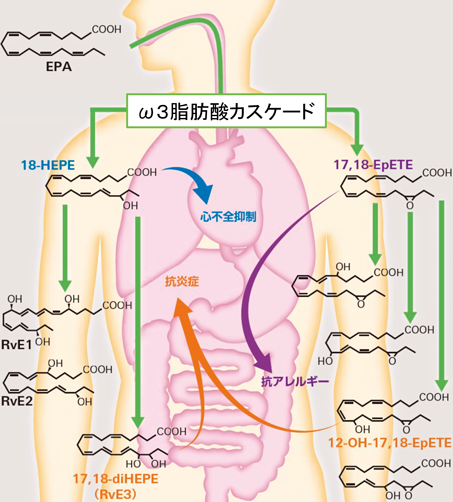
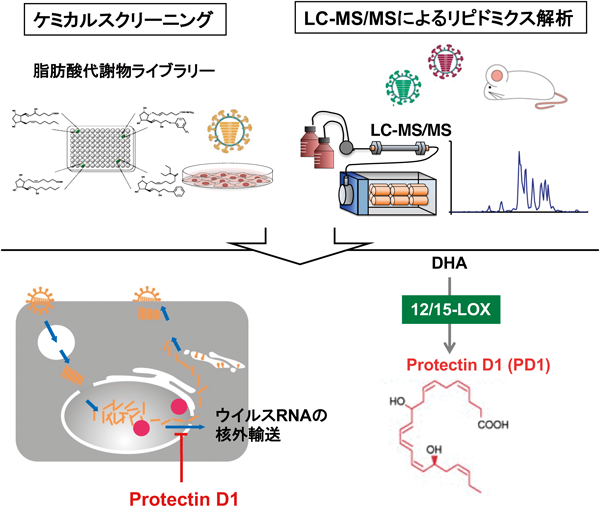
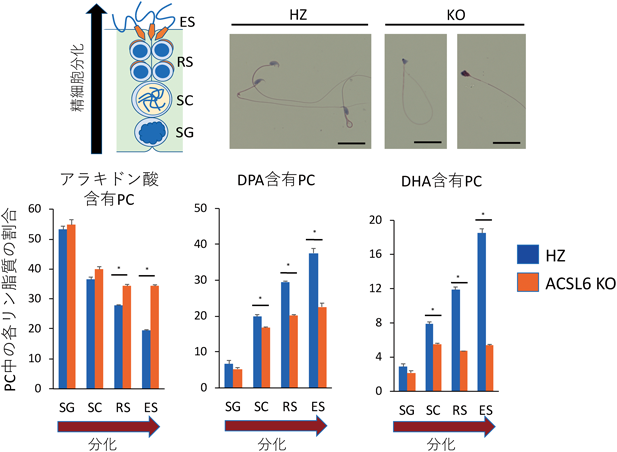
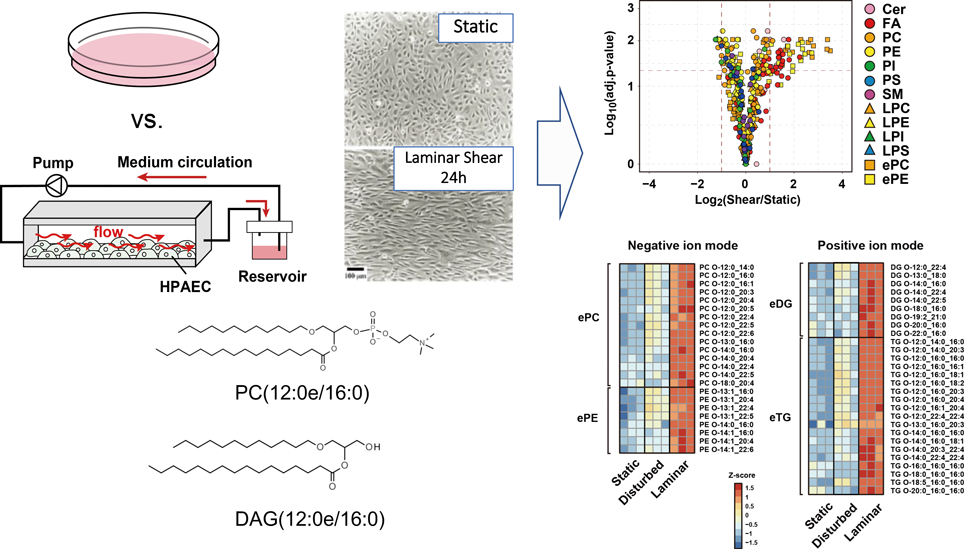
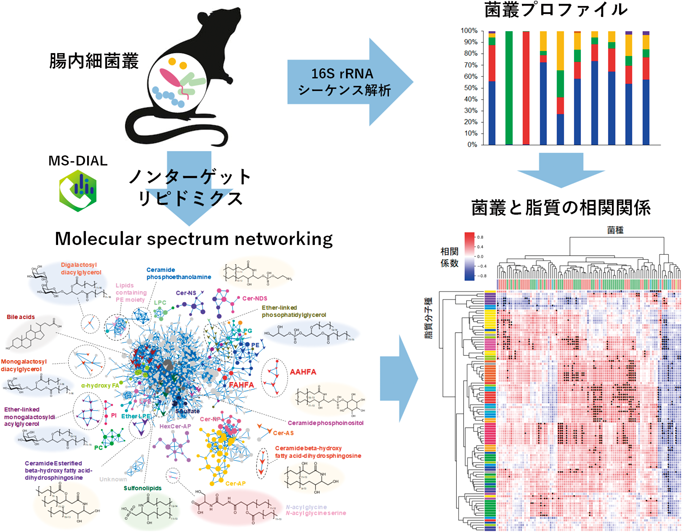
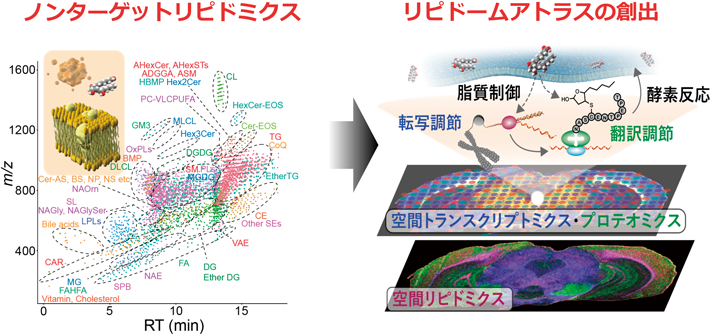
最先端リピドミクスで解き明かす生命の脂質多様性と疾患制御Lipid diversity and disease control revealed by advanced lipidomics
1 慶應義塾大学薬学部代謝生理化学講座Division of Physiological Chemistry and Metabolism, Keio University Faculty of Pharmacy ◇ 〒105–8512 東京都港区芝公園1–5–30 ◇ 1–5–30 Shibakoen, Minato-ku, Tokyo 105–8512, Japan
2 理化学研究所生命医科学研究センターメタボローム研究チームLaboratory for Metabolomics, RIKEN Center for Integrative Medical Sciences ◇ 〒230–0045 神奈川県横浜市鶴見区末広町1–7–22 ◇ 1–7–22 Suehiro-cho, Tsurumi-ku, Yokohama, Kanagawa 230–0045, Japan
3 横浜市立大学大学院生命医科学研究科代謝エピゲノム科学研究室Cellular and Molecular Epigenetics Laboratory, Graduate School of Medical Life Science, Yokohama-City University ◇ 〒230–0045 神奈川県横浜市鶴見区末広町1–7–29 ◇ 1–7–29 Suehiro-cho, Tsurumi-ku, Yokohama, Kanagawa 230–0045, Japan