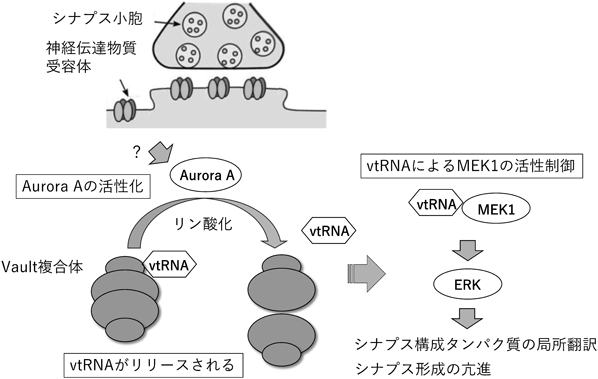
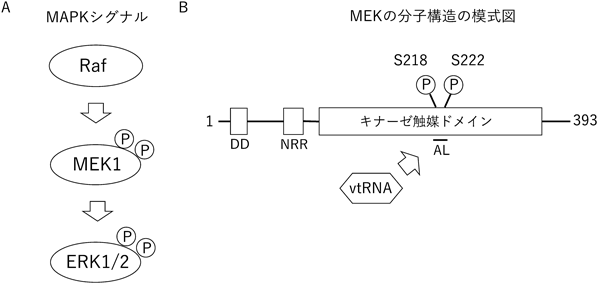
small non-coding vault RNAによるシナプス形成の調節機構Novel molecular mechanism for synapse formation by small non-coding vault RNA
国立神経医療研究センター神経研究所National Institute of Neuroscience, National Center of Neurology and Psychiatry ◇ 〒187–8502 東京都小平市小川東町4–1–1 ◇ 4–1–1 Ogawa-higashi, Kodaira, Tokyo 187–8502, Japan