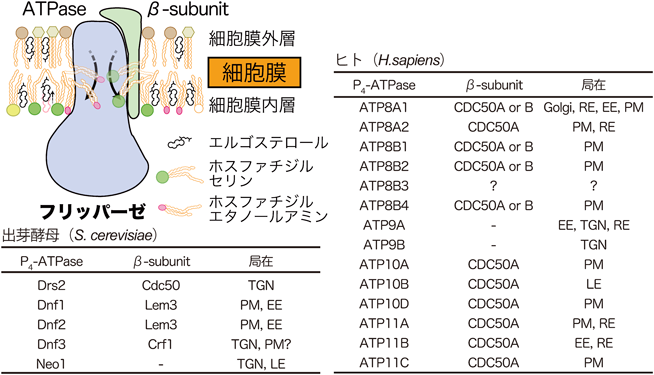
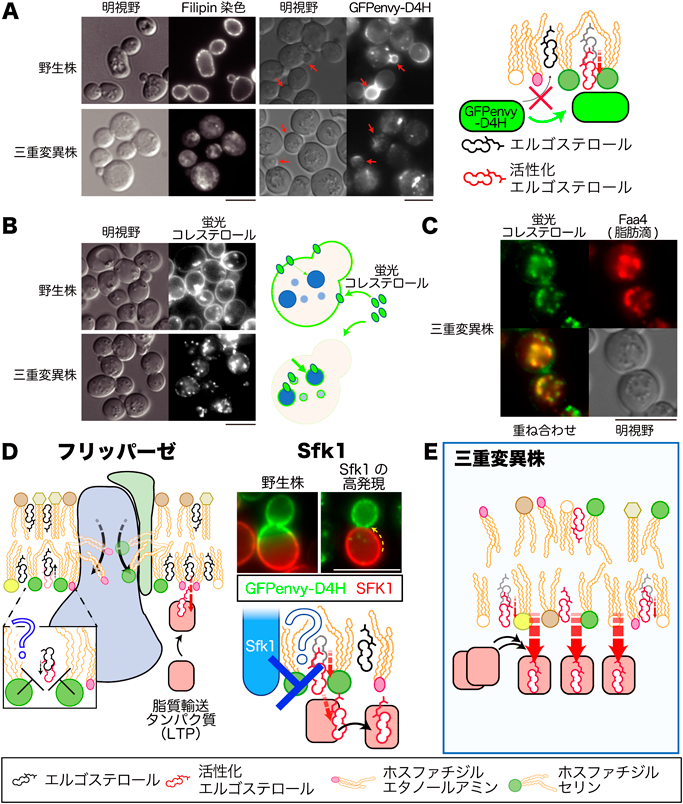
リン脂質非対称性により制御される細胞膜ステロールの保持機構Retention mechanism of plasma membrane sterols regulated by phospholipid asymmetry
北海道大学・遺伝子病制御研究所・分子間情報分野Division of Molecular Interaction, Institute for Genetic Medicine, Hokkaido University ◇ 〒060–0815 北海道札幌市北区北15条西7丁目 ◇ Nishi 7, Kita 15, Kita-ku, Sapporo, Hokkaido 060–0815, Japan