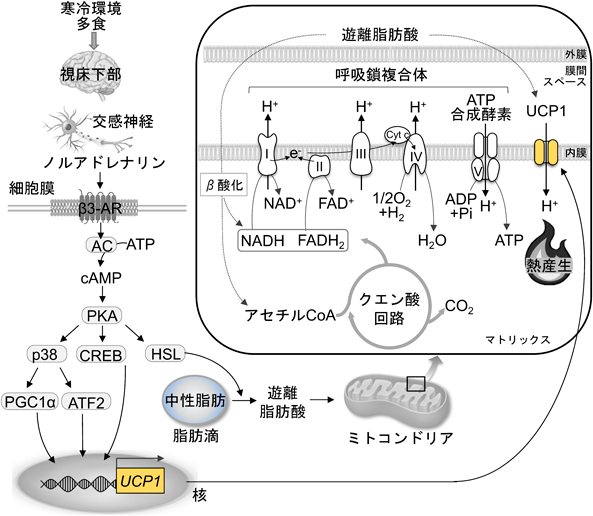
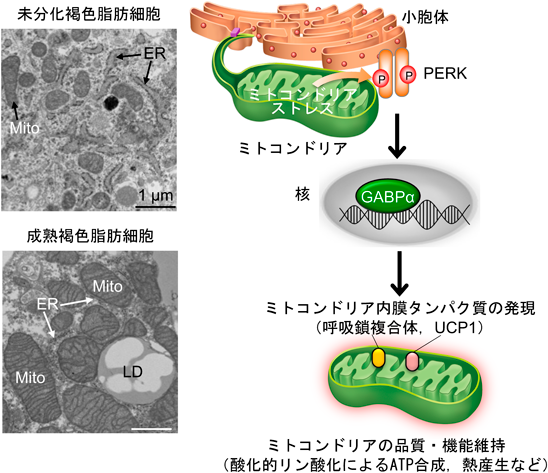
褐色脂肪組織における小胞体–ミトコンドリア間クロストークシグナルを介した熱産生Molecular mechanism of thermogenesis via ER-mitochondrial crosstalk signaling in brown adipose tissue
宮崎大学医学部機能生化学Laboratory of Biochemistry and Molecular Biology, Department of Medical Sciences, University of Miyazaki ◇ 〒889–1692 宮崎市清武町木原5200 ◇ 5200 Kihara, Kiyotake, Miyazaki 889–1692, Japan