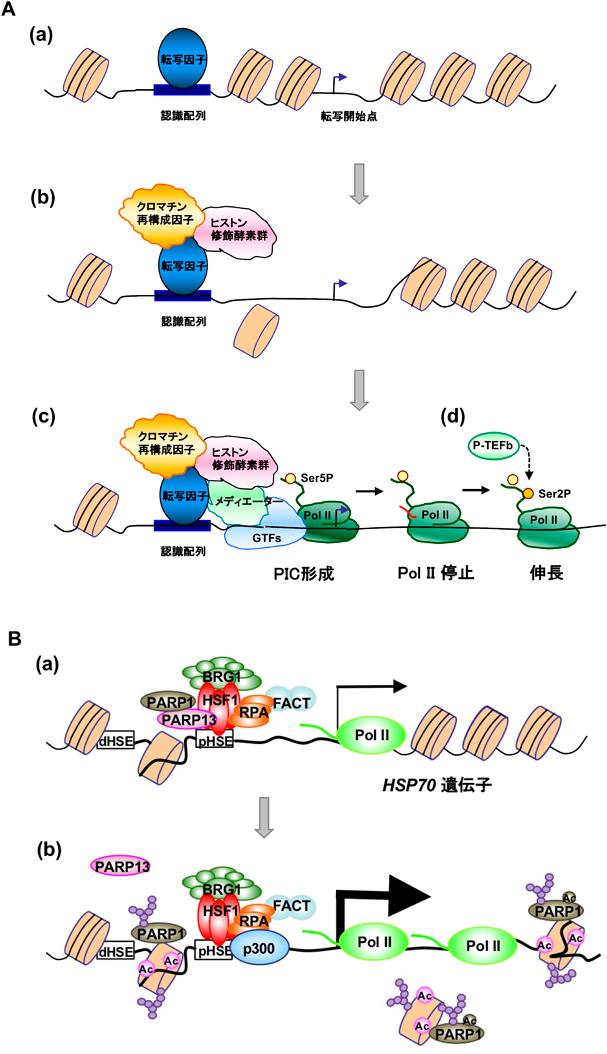
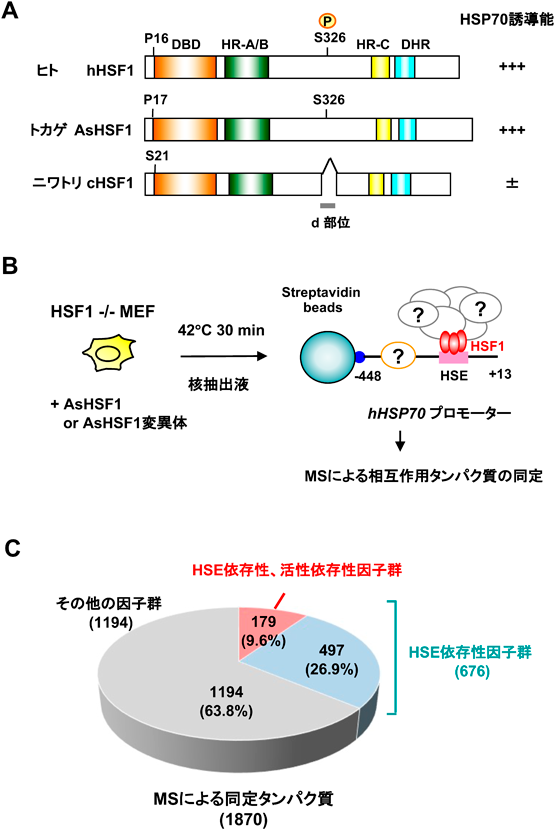
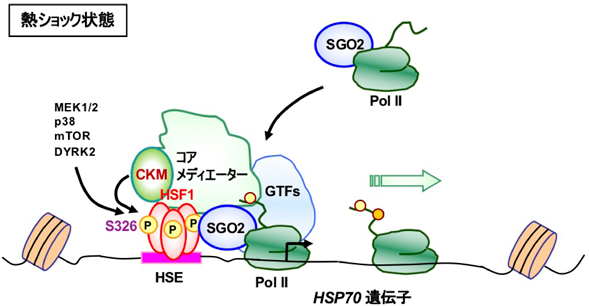
熱ショック応答における転写開始前複合体形成の調節機構Regulatory mechanisms of the transcriptional preinitiation complex formation in the heat shock response
山口大学大学院医学系研究科医化学講座Department of Biochemistry and Molecular Biology, Yamaguchi University Graduate School of Medicine ◇ 〒755–8505 山口県宇部市南小串1–1–1 ◇ 1–1–1 Minami-Kogushi, Ube, Yamaguchi 755–8505, Japan