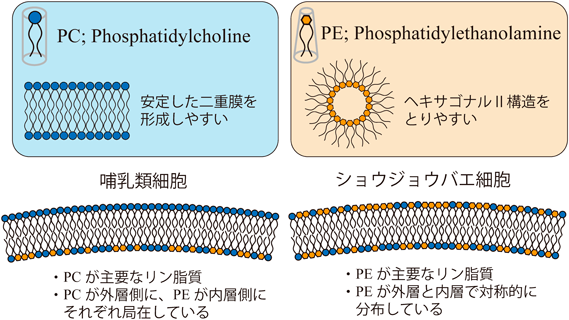
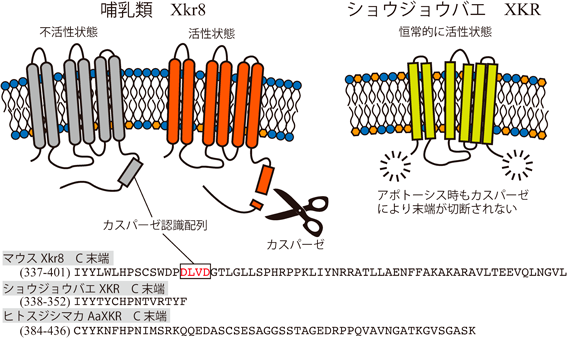
リン脂質輸送による細胞の変形能制御Regulation of cell deformability by phospholipid transport
1 理化学研究所新宅マイクロ流体工学理研白眉チームMicrofluidics RIKEN Hakubi Research Team, RIKEN ◇ 〒351–0198 埼玉県和光市広沢2–1 研究本館625号室 ◇ 2–1 Hirosawa, Wako-shi, Saitama 351–0198, Japan
2 京都薬科大学分析薬科学系薬品物理化学分野Department of Biophysical Chemistry, Kyoto Pharmaceutical University ◇ 〒607–8414 京都府京都市山科区御陵中内町5 躬行館4階 ◇ 5 Misasaginakauchi-cho, Yamashina-ku, Kyoto 607–8414, Japan
3 同志社大学メカノバイオロジー研究センターResearch Institute for Mechanobiology, Doshisha University ◇ 〒610–0394 京都府京田辺市多々羅都谷1–3 ◇ 1–3 Tatara Miyakodani, Kyotanabe-shi, Kyoto 610–0394, Japan
4 ホロバイオ株式会社HOLO BIO Co., Ltd ◇ 〒615–8245 京都府京都市西京区御陵大原1–36 京大桂ベンチャープラザ ◇ Katsura Innovation Park, 1–36, Goryo Ohara, Nishikyo-ku, Kyoto 615–8245, Japan