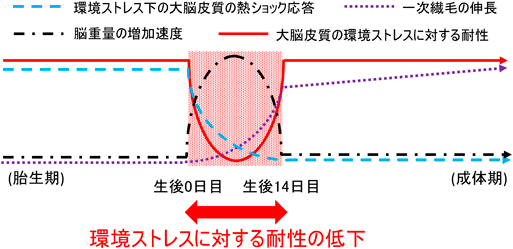
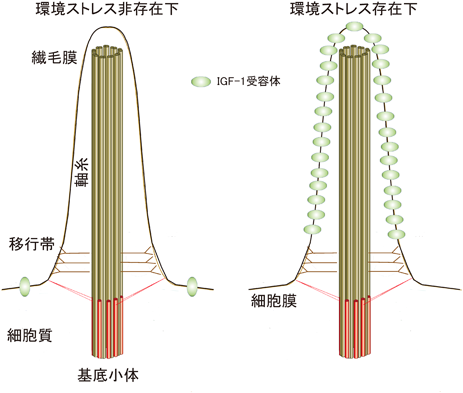
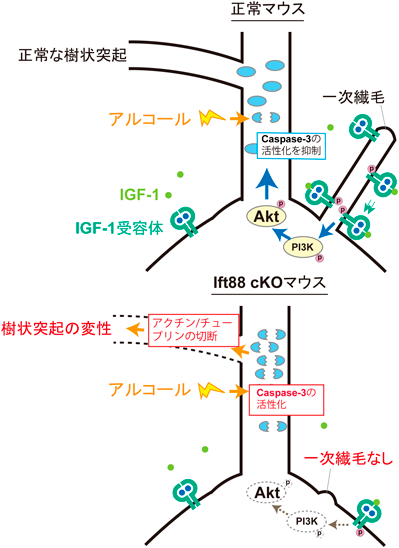
大脳皮質の一次繊毛が生み出す環境ストレス耐性機構の解明The elucidation of environmental stress-resistant mechanism generated by primary cilia in the cerebral cortex
慶應義塾大学医学部解剖学教室Department of Anatomy, Keio University School of Medicine ◇ 〒160–8582 東京都新宿区信濃町35 ◇ 35 Shinanomachi, Shinjuku-ku, Tokyo 160–8582, Japan