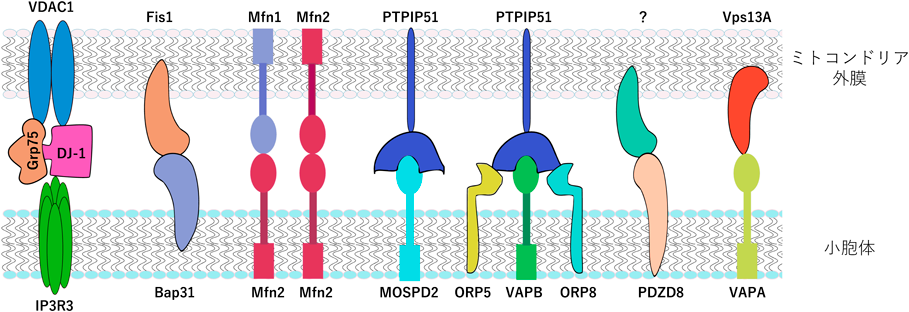
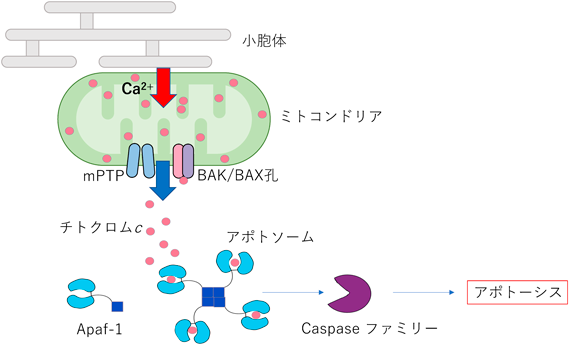
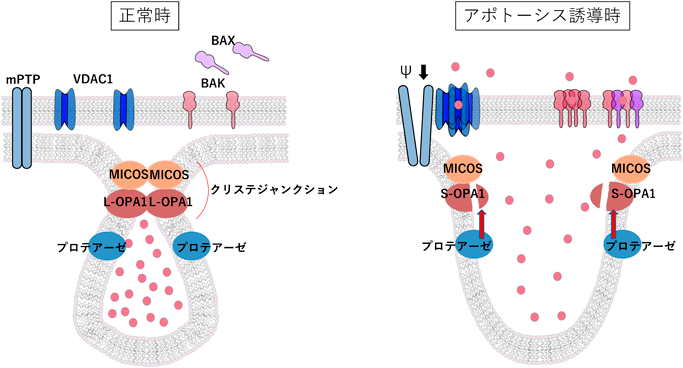
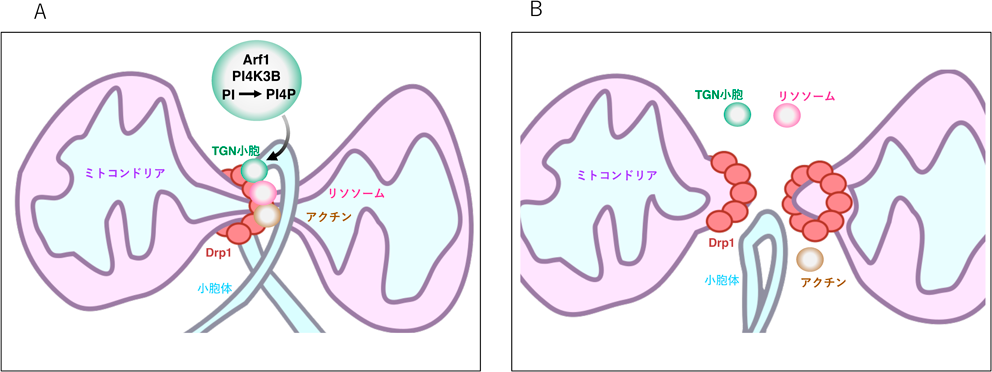
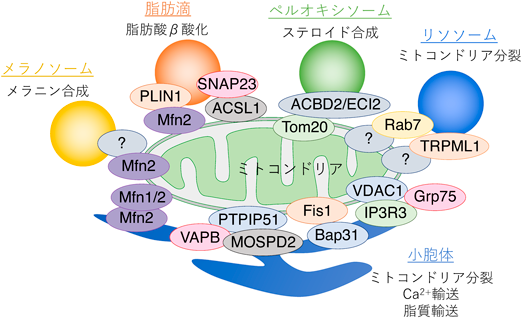
ミトコンドリアを介したオルガネラ間の連携Cooperation of mitochondria-organelle contacts
東京薬科大学生命科学部再生医科学研究室Laboratory of Regenerative Medicine, School of Life Sciences, Tokyo University of Pharmacy and Life Sciences ◇ 〒192–0392 東京都八王子市堀之内1432–1 ◇ 1432–1 Horinouchi, Hachioji, Tokyo 192–0392, Japan