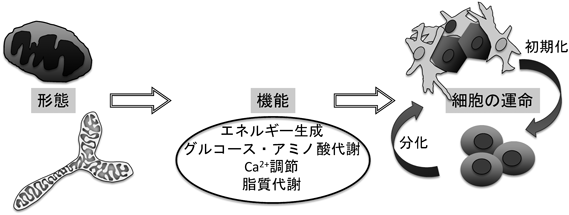
ミトコンドリアの形態が動的で可変的であることは,100年以上前にニワトリの胚から単離された生細胞で,すでに観察されている1).ミトコンドリアの形態は,さまざまな組織や細胞種によって特異的な形態を示し,それぞれの特徴的な機能と深く結びついている.ミトコンドリアの形態を制御するタンパク質のノックアウトマウスの研究や,培養系での分化誘導の実験によって,幹細胞と分化細胞のミトコンドリアの形態の違いは顕著であり,幹細胞の維持や細胞分化におけるミトコンドリア動態の意義が明らかになってきている(図1).
組織幹細胞は,ほとんどの胎生時および成人の臓器に存在し,自己複製能力と,特定の組織の複数の細胞種に分化する能力を持つ.成人では,組織幹細胞は主に組織の恒常性に関わり,損傷時の組織再生のために,幹細胞ニッチに静止状態で維持されている.幹細胞の自己複製能と分化のバランスは,適切な発生に重要であり,このバランスの崩壊は,がんを引き起こす可能性がある.ミトコンドリアは,最も大きなATP供給源であり,Ca2+を制御し,アポトーシスを調節し,代謝反応の中心地として機能している.これらミトコンドリアが制御する生命現象や,それに伴う生成物,たとえば,代謝産物,活性酸素種,イオン濃度などは,幹細胞の運命決定に重要な因子である.ミトコンドリア動態の細胞分化における役割,幹細胞の運命決定や細胞分化に必要な遺伝子発現を制御するシグナルと,ミトコンドリア動態との関連について,近年の研究報告を概説する.
2. 胚発生におけるミトコンドリア融合・分裂因子の役割
動的なミトコンドリアのネットワーク構造はGTP依存性ダイナミン関連タンパク質群によって形作られ,制御されている2).ミトコンドリア外膜融合は,細胞骨格のネットワーク構造によって促進され,Mitofusin(MFN)1と2によって行われる.MFN1およびMFN2は,ホモおよびヘテロ二量体を形成し,GTP加水分解によりそれらの高次構造が変化してミトコンドリア外膜を融合するとされる3, 4).MFNsは,E3リガーゼParkinによってユビキチン化され,p97によってプロテアソーム依存的に壊されることで,そのミトコンドリアをオートファジー(マイトファジー)によって分解させる5).一方でoptic atrophy 1(OPA1)は,ミトコンドリア内膜の融合制御に加えて6, 7),ミトコンドリア呼吸鎖酵素複合体が収容されるクリステの形態を調節する8–12)ため,ミトコンドリア呼吸鎖酵素複合体の超構造体の形成や安定性に関与する13).
ミトコンドリアの分裂は,細胞質に局在するDynamin-related protein-1(DRP1)によって制御されている.二量体もしくはオリゴマーのDRP1が,分裂部位にらせん状に凝集し,GTPの加水分解がオリゴマーのらせんピッチを減少させることで,ミトコンドリアを分裂させる14, 15).ミトコンドリアの分裂部位は,小胞体とミトコンドリアの接点で起こるが16),この部位で,小胞体に局在するinverted formin 2(INF2)がアクチン重合とMyosin IIを制御し,ミトコンドリアを効率よく分裂する17, 18).昨年,ミトコンドリアの分裂は2種類あり,中心部での分裂は,ミトコンドリア新生や娘ミトコンドリアを形成するために,ミトコンドリア外膜のDRP1アダプタータンパク質MFFを介して行われ,一方で,末端部での分裂は,ミトコンドリア外膜のDRP1アダプタータンパク質FIS1を介して行われ,機能低下や有害なミトコンドリアを除去するために行われることが示された19).
これらミトコンドリアの形態を制御する主要因子の胚発生過程における役割については,マウスモデルを用いて研究されており,上記すべての因子のそれぞれの欠損は,胚性致死を引き起こすことから,ミトコンドリア動態がいかに個体発生に欠くことのできない重要なオルガネライベントであるかがわかる.
栄養外胚葉に由来する倍数体栄養膜巨細胞(trophoblastic giant cell:TGC)は,ホルモンとサイトカインを分泌し,胎児と母体の境界面を維持するが,Mfn2ノックアウト胚では代謝異常と核内倍加の減少によって,TGCが劇的に減少し,胎盤異常を引き起こし,妊娠中期の胚性致死を引き起こす3).胎盤では,栄養膜幹細胞は最終的に合胞体栄養膜に分化し,妊娠中にプロゲステロンを産生するが,ミトコンドリア内膜のチトクロムP450scc(Cyp11a1)が,コレステロールの側鎖を切断し,プレグネノロンを生成し20),3β-水酸化ステロイド脱水素酵素がプレグネノロンをプロゲステロンに変換する21).ミトコンドリアの断片化やDRP1の発現増加,およびOPA1とMFN2の発現低下が,栄養膜のシンシチウム化で観察され,またOPA1の発現低下はコレステロールの取り込みとプレグネノロンの生合成を促進するため,ミトコンドリア動態がシンシチウム栄養芽層の成熟を制御していることが示唆されている22).
内部細胞塊系統でのミトコンドリア動態制御タンパク質のさらなる役割について,胎盤分化細胞でMfn2を欠損させないMeox2-Creを用いて解析されている.それであっても,Meox2-Cre/Mfn2loxpマウスは出生後にほとんどが死亡するため,マウスの初期発生において,MFN2がいかに重要であるかがわかる23).生き残ったMeox2-Cre/Mfn2loxpのマウス個体は動きやバランスが異常で,小脳のサイズが小さくなり,小脳特異的にMFN2を欠損させると,巨大なプルキンエ細胞の分解や,樹状突起の伸長,スパインの形成の障害が生じる23).
一方,Mfn1ノックアウトマウスはMfn2ほど強烈な異常は示さない.MFN1がミトコンドリア外膜融合にだけ働くのに対し,MFN2はミトコンドリア外膜融合に加えて,ミトコンドリアと小胞体をつなぐ機能を持つこと24)がノックアウトマウスの表現型の違いと考えられる.ミトコンドリアと小胞体の接点・接近面は,Ca2+や脂質の恒常性を制御し,神経変性疾患25, 26)やグリオーマ細胞の悪性度の違いに関与することが報告されている27).
骨格筋特異的にMfn1/2を欠損させると,重度の筋萎縮,繊維間腔へのミトコンドリアの蓄積,筋原線維の配位異常が生じ,点変異したミトコンドリアDNA(mtDNA)が増加する28).心筋細胞特異的にMfn1/2を欠損させた場合は,胚性9.5~10.5日の間で死亡し,生後心筋でMfn1/2を欠損させると,ミトコンドリアの断片化,呼吸障害,心筋症を示す29).外胚葉および中胚葉系臓器におけるMFN1およびMFN2の重要性は,上述のノックアウトマウスの研究から明らかになっているが,今後,膵臓や肺などの内胚葉系臓器の発生・分化におけるMFNsの解析によって,すべての胚葉発生における外膜融合因子MFNsの役割が明らかになると思われる.
Mfn2と同様に,Opa1ノックアウトマウスは胚性8.5日後に死亡し,OPA1も初期の発達に欠かせない因子であることがわかる30).OPA1は,ミトコンドリア内膜融合,クリステ構造制御12),アポトーシス時のチトクロムc放出の制御11),さらにミトコンドリア呼吸鎖酵素複合体の超構造体形成に関わり,効率的なATP産生の制御13)を行うなど多機能性である.そのため,OPA1は疑いようもなく,さまざまな組織の発生・分化に決定的に関わっていると考えられる.実際,OPA1は,マウス胚性幹細胞(embryonic stem cell:ES細胞)からの心筋細胞分化に必須であるが31),OPA1ヘテロ欠損マウスの心筋細胞では,クリステ構造不全で肥大したミトコンドリア形態を示し,ミトコンドリア膜透過性遷移孔(permeability transition pore:PTP)が開口し,ミトコンドリア内Ca2+の上昇に非感受性となっていることから,成体の心筋細胞の正常な機能維持にも必要であることがわかる32).
Drp1欠損マウスも胚性致死で,Mfn2ノックアウトと同様に,胎盤に栄養膜巨細胞層を欠き,機能する心筋細胞も失い,神経管形成時に必要なアポトーシスが正常に起こらず,神経管が正常に形成されない33).En1-Creマウスを用いて小脳,中脳,肢芽特異的にDrp1を欠損させると,出生後に死亡し,プルキンエ細胞のミトコンドリアは異常に巨大な形態を示す34).Nestin-Creマウスを用いた別の脳特異的Drp1欠損マウスでは,アポトーシスの増加による前脳形成不全で,同様に致死性を示す35).これらのノックアウトマウスの前脳からの初代細胞培養によって,神経突起の減少とシナプス形成の欠陥が観察されており,前脳の発達におけるDRP1の重要性が示されている35).
Notch, Wnt, YAP/TAZシグナルは幹細胞の維持に必要であり,また,幹細胞から特異的で機能的な組織細胞への分化と発達に不可欠である.近年の研究から,ミトコンドリアが細胞内外の情報に反応してシグナル経路を調整する中心地となりうることがわかってきており,ミトコンドリア動態がどのようにシグナル経路と関与し,細胞の運命決定,分化・発達に関わっているか概説する.
1)Notch
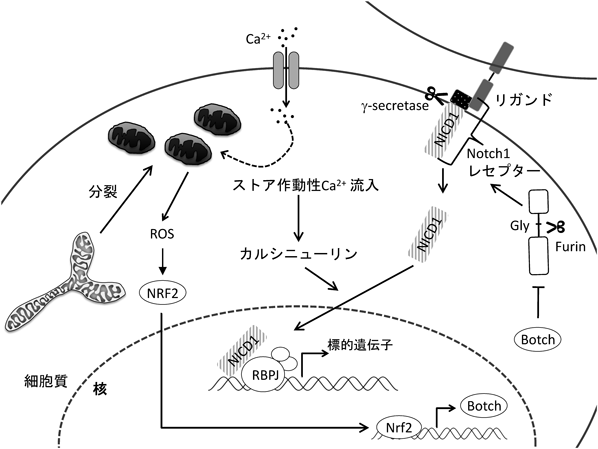
Notchシグナルは,モルフォゲンとは異なり,限られた特定の範囲の細胞間コミュニケーションを可能にする.Notchシグナルは,細胞の増殖,生存,移動,分化,発達に不可欠である36).標準的な(canonical)Notchシグナルは,細胞間接触を伴うparacrineシグナルで,このシグナルを遺伝子発現に変換する.Notch受容体発現細胞が近接するリガンド発現細胞からシグナルを受け取ると,Notch受容体にリガンドが結合し,受容体のマスクされていたタンパク質分解部位が生理学的力により露出する.露出した部位はγ-secretaseにより切断され,Notch細胞内ドメイン(Notch intercellular domain:NICD)が細胞質に放出される37).NICDは核内に移行し,RBPJ転写因子に結合することにより,Notchシグナルの標的遺伝子の転写を誘導する(図2)36).
ショウジョウバエの卵胞細胞の発達過程において,Notchシグナルは有糸分裂のサイクルから離脱し,後部卵胞細胞(posterior follicle cell:PFC)への分化を導く.EGF受容体シグナル伝達に伴うDRP1依存のミトコンドリアの断片化は,NICDの放出を介して,細胞の増殖停止とPFC前駆細胞の分化に必要である38).DRP1とミトコンドリアの断片化がNotchシグナルの上流因子なのか,もしそうなら,どのような分子メカニズムなのかは不明であるが,この研究はミトコンドリア動態とNotchシグナルを初めてつなぐ報告であった.
その後,著者らが哺乳細胞で,ミトコンドリア融合因子とNotchシグナルの新しいつながりを見いだした.Mfn1/2両方を欠損させたマウス心臓は,発生過程で心筋細胞の増殖低下を示し,また,Mfn2もしくはOpa1を発現低下させたES細胞は心筋細胞への分化能が低下する31).Notch1シグナルは心筋分化の抑制因子であり,実際Notch1リポーターアッセイによって,Mfn2もしくはOpa1を発現低下させたES細胞は,未分化,心筋分化2日,4日,8日のすべての分化過程で,Notch1活性が上昇していた31).また,Mfn1/2両方を欠損させた胚性心臓のDeep RNAシークエンス解析で,また,Mfn2もしくはOpa1の発現を低下させたES細胞から分化させた心筋細胞でも,Notch1シグナルの下流標的遺伝子であるMef2c2, Gata4転写因子の発現が低下しており,ミトコンドリア融合因子の発現低下によってNotchシグナルが亢進し,心筋分化が抑制されていることがわかる.ミトコンドリア融合因子の発現低下によって,ミトコンドリアが断片化し,かつ細胞膜近傍の局在へと変化することで,ストア作動性Ca2+流入の上昇による細胞質Ca2+の上昇が生じ,それによってカルシニューリンが活性化する31).細胞質Ca2+を上昇させる,もしくはカルシニューリンを阻害することで,Notch1活性が変化するため,ミトコンドリア形態と細胞内局在変化によって引き起こされた細胞質Ca2+上昇がカルシニューリンを活性化し,Notch1活性を亢進させている(図2)31).
ミトコンドリアの形態とNotchシグナルとの関連は,心臓以外の組織でも報告されている.たとえば,Notchシグナルは神経幹細胞(neural stem cell:NSC)の自己複製能に必要であるが,NSCの生成やニューロンやグリア細胞への分化は阻害する39).Notch受容体はNSCの非対称分裂の際に不均一に分布する40).発生過程のマウス脳では,NSCが局在する脳室側領域(ventricular zone)の脳室帯のミトコンドリアは伸長しているが,神経再生が起こる場所の一つである脳室下帯(subventricular zone)では断片化したミトコンドリアが観察される41).したがって,ミトコンドリアの形態とNotchシグナルに何らかの関連があることがわかる.さらに,ミトコンドリア融合変異体では,脳室帯で頂底軸に沿った垂直分裂が増加し,逆にミトコンドリア分裂変異体では水平分裂が増加しており,非対称分裂にミトコンドリア動態が関与していることが示唆された.ミトコンドリア呼吸鎖酵素複合体でATP合成の過程で生成される活性酸素種(reactive oxygen species:ROS)は,生理学的なROSレベルでは幹細胞の運命決定に不可欠な要因と考えられており42),NSCが終末分化する過程で,ROSレベルと抗酸化反応の主要転写因子NRF2の発現はミトコンドリアの断片化によって調整される41).BotchはNotchを脱グリシンするγ-グリタミル環状転移酵素で,NotchのS1フューリン(Furin)様切断を防ぎ,Notchの活性化を阻害する43).NRF2はBotchの転写を亢進させ,間接的にNotchシグナルを阻害する(図2).したがって,ミトコンドリアの形態はNotchシグナルと協調して,幹細胞の維持,分化,さらに組織構築の根本的な手続きである細胞分裂軸の調節に役割を果たす可能性が示唆されている.
2)Wnt
Wntシグナルは,臓器の発達,TSCの維持,自己複製,および分化を調節するが,異常なWntシグナルは腫瘍を引き起こす44).Wntシグナルは,Wnt3aなどのモルフォゲンやβ-カテニンにより媒介され,主に成体幹細胞ニッチで近接の細胞間で起こる反応である45).標準的なWntシグナルはβ-カテニンに依存し,非標準的な(non canonical)Wntシグナルはβ-カテニンに依存しない46).非標準的なWntシグナルにおいては,Wntリガンドが存在しない場合,β-カテニンは,Axin, glycogen synthase kinase-3(GSK-3),YAP/TAZ, casein kinase 1(CK1),adenomatous polyposis coli(APC),そしてβ-TrCPで構成される破壊複合体によって分解される.一方で,Wntリガンドの存在下では,Wntは細胞質膜で破壊複合体とリン酸化型LRPの結合を促し,その結果,β-TrCPによるβ-カテニンのユビキチン化が阻害され,β-カテニンがWntの核内効果因子であるTCF/LEF転写因子へ結合できるようになる44, 47, 48).非標準的なWnt経路では,Wntリガンドの結合したFrizzled(Fz)受容体が,Rac1, RhoA,そして下流因子のc-Jun N末端キナーゼ(JNK)を活性化し,細胞骨格と遺伝子発現を再構成する.この経路は,組織が一方の軸を狭め,もう一方の軸を伸ばす収束伸長のプロセスに関与しており49),発達中の心臓の流出路伸長に重要である50).Wnt-Ca2+経路は,もう一つの非標準的なWnt経路で,WntリガンドはFzに結合し,phospholipase C(PLC)を活性化して,細胞内貯蔵からCa2+放出を引き起こす.これは,神経変性疾患やがんを引き起こすカルシニューリンと不活性化T細胞核内因子の活性化につながる51).
標準的なWntシグナルは,造血幹細胞のミトコンドリア膜電位を低下させ,アポトーシスを誘導する52).メラノーマ細胞では,Wnt3aはMfn1, Mfn2,およびOpa1の発現上昇,およびDrp1の発現低下を引き起こし,ミトコンドリアの形態を伸長させる53).興味深いことに,標準的なWntシグナルはミトコンドリアのオートファジーであるマイトファジーを阻害することで,ミトコンドリアの呼吸に影響を与える53).海馬ニューロンのCA1領域では,非標準的Wntシグナルが,ミトコンドリアの分裂・融合を制御する54, 55).非標準的Wntリガンドの一つであるWnt5aは,細胞質Ca2+とミトコンドリア内Ca2+の両方を増加させ,それはDRP1のSer-616におけるリン酸化状態と相関する54).Alex3,もしくはARMCX3はミトコンドリアに局在するタンパク質で,神経細胞でKinesin/Miro/Trak2複合体と相互作用し,ミトコンドリアの輸送と動態を制御する56).非標準的Wnt経路は,このAlex3タンパク質の安定性に関わり,ミトコンドリアの形態も調節する57).したがって,Wntsシグナルはミトコンドリア動態と機能を制御することがわかってきているが,一方で,胚発生や細胞の分化過程において,ミトコンドリア動態がNotch1シグナルを制御したように,Wntシグナルを変化することができるのか,今後の研究に期待したい.ミトコンドリア自体の関与はないが,ミトコンドリア外膜融合因子MFN2が細胞膜でβ-カテニンと結合し,細胞間接着を安定化させることで,炎症を抑制していることが報告されている58).
3)YAP/TAZ
YAP(Yes-associated protein)およびTAZ(transcriptional coactivator with PDZ-binding motif)は転写因子TEAD/Scallopedの共役因子であり,細胞質と核の間を往復する.YAP/TAZシグナルの最も注目すべき役割の一つは,臓器のサイズ制御である59).YAP/TAZの下流因子は,細胞周期を進行させるシグナルネットワークとつながっており60, 61),YAP/TAZ活性は,F-アクチンのキャッピング/切断タンパク質によって調節される.YAP/TAZシグナルは,分化状態の可塑性も管理するため,マウス初代培養細胞を組織特異的な前駆細胞/幹細胞に脱分化させることができる62).
ミトコンドリア動態とYorkie/YAPの相関がショウジョウバエで示されている.Yorkie活性化はミトコンドリアを融合させ,opa1, Marf(ショウジョウバエのMFN2)の発現を上昇させる63).opa1の発現低下は,Yorkieが誘導する細胞増殖と組織の異常増殖を抑制する63).YAP-ミトコンドリア相互作用は種間で保存されており,YorkieのヒトホモログであるYAP2の過剰発現は,ヒト乳がん細胞でミトコンドリアの融合を引き起こす63).ミトコンドリア動態とYAP/TAZシグナルの別の関連性は,乳腺上皮および乳がん細胞で示されている.DRP1阻害剤として知られていた(しかし呼吸鎖酵素複合体Iをより阻害することが後に報告されている64))mdivi-1,もしくは機能阻害変異体Drp1K38Aは,YAP/TAZ標的遺伝子であるCTGF, CYR61発現を抑制する65).この効果は,ミトコンドリアの形態変化によって引き起こされた代謝変化で,AMP活性型キナーゼによって媒介されると推察されている.幹細胞・細胞分化におけるYAP/TAZとミトコンドリア動態については今後の研究に期待したい.
脱分化は,分化している細胞が最終分化の前に一つ前の発生段階の未分化/前駆細胞の状態に戻るプロセスであり,有尾両生類の網膜色素上皮(retinal pigment epithelial:RPE)細胞で初めて観察された.RPE細胞は分化した細胞の特性を失った後,脱分化し,摘出された水晶体細胞に置き換わることができた66).
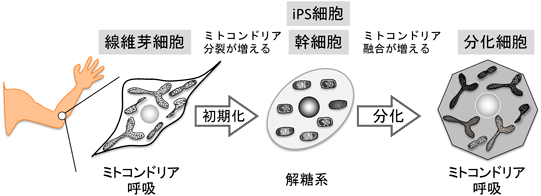
極端でわかりやすい例は,人工多能性幹細胞(induced pluripotent stem cell:iPS cell)で,最終分化した,たとえば線維芽細胞の初期化によって作製される.iPS細胞はES細胞と同様に解糖系に依存したエネルギー代謝を行い,ミトンドリア分裂因子DRP1の活性化とそれに伴った断片化したミトコンドリアが観察される67).最終分化した細胞のミトコンドリア呼吸から,解糖系依存に変わるこの代謝転換が,細胞の初期化に重要である68).言い換えると,ミトコンドリア呼吸に代謝依存し,ミトコンドリアの形態が伸長することで,幹細胞は多能性を失う(図3)69).ミトコンドリア膜の再構築は代謝の変化に対する急性な反応であり70, 71),ミトコンドリア動態はこの解糖系-ミトコンドリア呼吸の代謝シフトを調節する72).したがって,ミトコンドリア動態は,細胞初期化過程において,最も上位に位置し,ミトコンドリアの形態変化が,ミトコンドリア呼吸鎖酵素複合体が埋まる内膜構造を変化させ,代謝シフトを引き起こし,分化細胞に幹細胞性を与える.実際,ミトコンドリア分裂因子DRP1に依存したミトコンドリアの断片化が分化細胞の初期化に必要であり67),ミトコンドリア融合因子MFN1/2の欠損は線維芽細胞からiPS細胞への誘導を促進する73).
ミトコンドリア動態はまた,代謝転換を通じてT細胞の運命を調節する.ナイーブT(TN)細胞は増殖性が高く,エフェクターT(TE)細胞に分化する74).TE細胞は抗原が除去されると死ぬが,メモリーT(TM)細胞は長生きし,遭遇した抗原の記憶を保持して,次の感染またはがんの再発の際にTE細胞に供給する.TE細胞は解糖系に依存するが,TM細胞は脂肪酸酸化に代謝依存する.興味深いことに,TM細胞は伸長したミトコンドリア形態を示すのに対し,TE細胞は断片化したミトコンドリア形態を示す74).OPA1は感染後TM細胞にのみ必要で,TE細胞にmdivi-1を処理し,ミトコンドリアの分裂阻害によりミトコンドリアを伸長させると,TMへの分化を誘導し,抗腫瘍能が上昇する74).抗原刺激で,TM細胞のミトコンドリアは断片化し始め,解糖系に依存し始める.どのような生理学的な化合物が,抗原刺激によってTM細胞のミトコンドリアを断片化しているのかはわかっていないが,この研究によってT細胞の分化と脱分化のプロセスにミトコンドリア動態が密接に関与していることが示された.
分化転換は,ある特定の細胞系統に分化した細胞が別の系統の成熟細胞に形質転換することである.骨髄間葉系幹細胞から肝細胞への分化転換過程で,分化転換した肝細胞のミトコンドリアは短い形態を示すが,細胞はミトコンドリア呼吸に代謝依存する75).長期培養によって,初代培養肝細胞は極性と分化細胞特有の肝機能を失い,前駆細胞に脱分化する76).この初代培養肝細胞の脱分化過程で,ミトコンドリアは伸長する75).異なる組織間でいくつかの分化転換が観察されており,ミトコンドリア動態が代謝制御因子として,またシグナル伝達と協調して,この細胞系統を超えた分化転換にどのように関与しているかは,将来の研究として興味深い.