ミトコンドリアは,生体内のエネルギー産生の大部分を担っている重要な細胞小器官(オルガネラ)である.ミトコンドリア内膜の電子伝達系を介してエネルギーとしてのATPを産生するが,電子伝達の過程において活性酸素種(reactive oxygen species:ROS)が発生するため,ミトコンドリアは絶えずROSによる酸化ストレスにさらされている.このため,ミトコンドリアにはROSを除去するための抗酸化酵素が備わっており,酸化ストレスに適応してミトコンドリアの品質が維持されている.しかし,ROSの過剰発生や抗酸化能の低下により酸化ストレスに対して適応できなくなると,ミトコンドリアはROSをさらに発生しやすくなり,他のミトコンドリアや細胞自体へ悪影響を及ぼす.このため細胞には,このような障害が蓄積したミトコンドリアをオルガネラごと分解し,細胞から除去する仕組みが備わっており,ミトコンドリア品質管理と呼ばれている.このミトコンドリア品質管理において,若年性パーキンソン病の原因遺伝子産物であるPINK1(PTEN-induced putative kinase 1)とParkinが関与しており,これまで複数のグループによる研究を通して,PINK1とParkinを介したミトコンドリアの選択的分解機構が明らかにされてきた1).
ミトコンドリアは,αプロテオバクテリアが宿主細胞へ共生することによってでき上がったと考えられており,ミトコンドリアの獲得により真核生物は酸素を用いてエネルギー生産ができるようになった.一方で,ミトコンドリア自身も細胞に共生することで,その機能の多くを細胞に移行した.ヒトでは1500種以上あるミトコンドリアタンパク質の約99%は核ゲノムにコードされており,これらは細胞質の転写・翻訳系によって合成される.また,細胞質においてリン酸化やアセチル化などの翻訳後修飾を受けることで,タンパク質の発現量や局在,機能が調節される.そのため,細胞内の環境はミトコンドリアの機能に大きな影響を及ぼしており,細胞環境に応じて機能を変化させることでミトコンドリアもさまざまな適応を示す.たとえば,ストレスにさらされた細胞のミトコンドリアでは,ROSの過剰生産に加えて,マトリックスにおける凝集タンパク質の蓄積やミトコンドリアDNAの損傷などさまざまな障害が生じるが,これに対してミトコンドリアストレス応答経路が働き,ミトコンドリア特有のシャペロンやプロテアーゼの発現が増加する2).またミトコンドリアの形態も細胞環境に応じて変化し,通常はネットワーク構造をとるミトコンドリアは,ストレス環境下では断片化が進む3).
細胞内の環境に応じてミトコンドリアの機能は大きく変化するため,ミトコンドリアの機能を理解するにあたり細胞環境が与える影響を考慮することは非常に重要である.本稿では,ミトコンドリア品質管理が細胞内の環境に応じてどのように調節され適応しているのか,筆者らの研究を中心に最近の研究動向を踏まえて紹介する.
2. PINK1とParkinを介したミトコンドリア品質管理
1)膜電位が維持されたミトコンドリアにおけるPINK1の分解
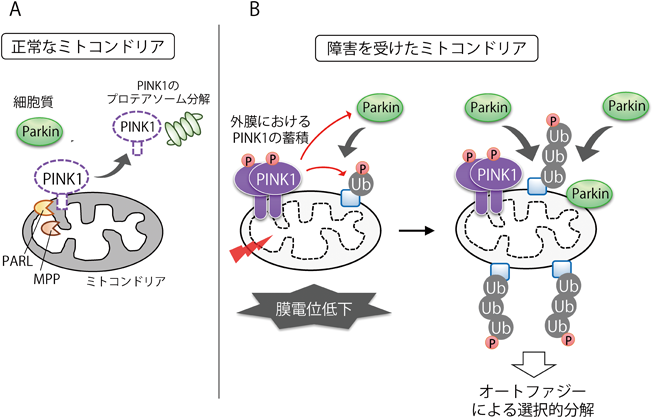
PINK1は,N末端側にミトコンドリア移行シグナルと膜貫通領域を持ち,C末端側にキナーゼドメインを持つセリン・トレオニンキナーゼである.細胞質で合成された後,PINK1のN末端側は,外膜と内膜の膜透過装置(TOM40複合体・TIM23複合体)を介してミトコンドリアマトリックスまで到達する.内膜のTIM23複合体を介したタンパク質輸送は内膜の膜電位とミトコンドリア移行シグナルによって駆動されており,PINK1についても同様に,膜電位とミトコンドリア移行シグナル依存的に内膜透過される.PINK1はC末端側を細胞質に残した状態でN末端側がマトリックスまで到達すると,マトリックスペプチダーゼのMPP(mitochondrial processing peptidase)によりN末端が切断され,さらに内膜プロテアーゼのPARLにより膜内切断を受ける.N末端側が切断されたPINK1は細胞質へと逆行輸送され,最終的にプロテアソームによって分解される.このため,膜電位が維持された正常なミトコンドリアでは,PINK1は常に分解を受けており,ミトコンドリア上でキナーゼ活性を発揮することはない(図1A)4).
2)障害ミトコンドリアにおけるPINK1とParkinの活性化
障害が蓄積しミトコンドリア内膜の膜電位が低下すると,内膜のTIM23複合体によるタンパク質輸送が阻害される.このため,PINK1のN末端側はTOM40複合体を介して外膜を通過した後に内膜へ挿入されることができず,MPPやPARLによる切断も受けない.代わりにPINK1はミトコンドリア外膜上で二量体を形成して安定化し,TOM40複合体を含む巨大複合体を作る5).複合体形成と同時に,PINK1は自己リン酸化によって活性型のPINK1となり,ミトコンドリア外膜上のユビキチンやParkinのユビキチン様ドメインをリン酸化する1, 6, 7).Parkinは通常は細胞質に蓄積しているが,ミトコンドリア外膜上のリン酸化ユビキチンとの親和性によりミトコンドリア外膜に移行し,同時にParkin自身もリン酸化されることで活性化する.活性型Parkinの働きによりミトコンドリア外膜上にポリユビキチン鎖が付加され,このポリユビキチン鎖が目印となってオートファジーによる分解が引き起こされる.この過程において,PINK1の蓄積によって生じるリン酸化ユビキチンの量は非常にわずかであるが,これに続くParkinの活性化やPINK1とParkinによるさらなるリン酸化ユビキチンの付加によって,Parkinのミトコンドリア移行とポリユビキチン鎖の付加はポジティブフィードバック効果で進行する(図1B)8).
言い換えれば,PINK1がほんのわずかな量でも外膜上で活性化すれば,Parkinのミトコンドリアへの移行とマイトファジーが引き起こされることになる.正常なミトコンドリアにおいて,ポリユビキチン鎖の付加によるポジティブフィードバック効果が誤って引き起こされることのないようにするためには,PINK1の活性化は厳密に制御されている必要があると考えられる.筋肉組織や神経細胞などエネルギーを多く消費する組織はミトコンドリアの機能に大きく依存しており,ミトコンドリアの膜電位は増減しやすい.こういった組織においてPINK1とParkinが容易に活性化してしまわないためには,PINK1の外膜上での活性化に対して,膜電位とは別の多くの調節機構が働いていると推測される.ミトコンドリア品質管理の制御機構については,いまだ不明な点が多く残っており,筆者らは,細胞内環境に着目してミトコンドリア品質管理の制御機構の解析を行った.
3. ミトコンドリア品質管理におけるcAMP/PKAシグナル経路の関与
1)フォルスコリンの処理はParkinのミトコンドリア移行を阻害する
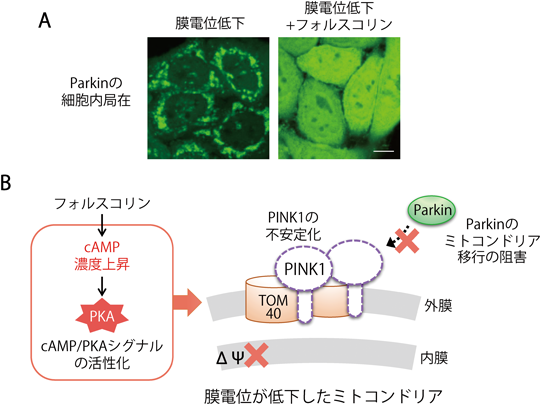
緑色蛍光タンパク質融合Parkin(GFP-Parkin)を安定的に発現するHeLa細胞において,脱共役剤であるCCCP(carbonyl cyanide m-chlorophenylhydrazone)を処理するとミトコンドリア膜電位が低下し,GFP-Parkinがミトコンドリアに局在する.筆者らは,細胞内の情報伝達物質であるcAMPに着目して,アデニル酸シクラーゼのアゴニストであるフォルスコリンを用いて細胞内のcAMP濃度を上昇させた.その結果,フォルスコリンの処理によってGFP-Parkinのミトコンドリアへの移行が著しく阻害されることを見いだした(図2A).このことは,細胞質におけるcAMP濃度が上昇すると,膜電位が低下してもParkinがミトコンドリアに移行できなくなることを示している.
2)PKAの活性化はParkinのミトコンドリア移行を阻害する
cAMP濃度の上昇は,細胞内のさまざまなシグナル伝達に関与するが,その主な機能としてPKA(protein kinase A)の活性化があげられる.これまで,障害を受けたミトコンドリアの選択的分解機構においてcAMP濃度の影響やPKAシグナル経路の関与は知られておらず,筆者らのグループは,ミトコンドリア品質管理機構におけるcAMP/PKAシグナル経路の関与について解析を進めた.フォルスコリンの処理によるParkinのミトコンドリア移行の阻害が,PKAの活性化に起因するものかどうかを確認するために,PKAの阻害剤であるH89をGFP-Parkinを発現するHeLa細胞に処理した.通常,低濃度5 µMで30分のCCCP処理では膜電位の低下が不十分なために,Parkinはミトコンドリアに局在することはできず,細胞質に蓄積する.これに対して,H89を処理するとParkinのミトコンドリアへの移行がみられ,PKAを阻害することによりParkinのミトコンドリア移行が促進されることがわかった.PKAは調節サブユニットと触媒サブユニットから構成されており,cAMP濃度の上昇に伴い触媒サブユニットが解離し活性化する.そこで,PKAの触媒サブユニットを細胞で過剰発現させると,膜電位が低下したミトコンドリアへParkinが移行できなくなった.これらの結果から,cAMP濃度の上昇に伴ってPKAが活性化すると,ミトコンドリア膜電位が低下してもParkinがミトコンドリアへ移行できなくなることがわかった.
3)cAMP/PKA経路の活性化はPINK1の安定性を低下させる
PINK1の外膜上での活性化についてcAMP/PKAシグナル経路の関与を調べるため,PINK1の発現量をウェスタンブロットによって解析した.CCCPの処理によってミトコンドリア膜電位を低下させると,PINK1は分解されずに外膜上に蓄積するため,ウェスタンブロットでPINK1が検出できる.これに対してフォルスコリンを処理した細胞では,外膜に蓄積するPINK1の量が減少していた.逆に,H89を処理するとPINK1の量が増加した.このことから,フォルスコリンの処理によりPKAが活性化すると,PINK1の外膜における安定性が低下し,外膜上で十分な量のPINK1が蓄積しないためにParkinがミトコンドリアに移行できなくなることが明らかになった(図2B).
4. ミトコンドリア品質管理におけるMIC60とMIC19の役割
1)MIC60はPKAによりリン酸化される
これまで,cAMP/PKAシグナル経路を介したミトコンドリアの機能調節についてさまざまな報告がされている.内膜の呼吸鎖複合体サブユニットのNDUFS4はPKAによるリン酸化によってミトコンドリアへの輸送が制御されており9),また,ミトコンドリア外膜のTOM70は,リン酸化を介してタンパク質の外膜透過機能を調節している10).ミトコンドリアの分裂を担うDrp1は,PKAを介したリン酸化によりGTPase活性が制御されており,ミトコンドリア形態に影響を及ぼす11).ミトコンドリアに局在するAキナーゼアンカータンパク質(A-kinase anchoring protein:AKAP)の存在についても報告されており12),ミトコンドリアタンパク質が効率的にPKAによるリン酸化を受けることがわかる.一方で,PKAによるリン酸化モチーフは保持しているがリン酸化の機能は未知の因子も多数存在する.また,ミトコンドリアマトリックス内のアデニル酸シクラーゼ活性の報告など,ミトコンドリア内でのPKAによるリン酸化反応についても議論されており13),cAMP/PKAシグナル経路を介したミトコンドリアの機能調節については,不明な点が多く残っている.
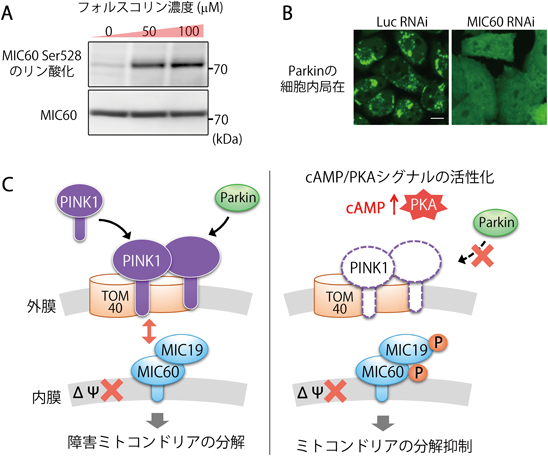
cAMP/PKA経路の活性化によってPINK1とParkinの機能が阻害されることから,筆者らは,ミトコンドリアタンパク質のPKAによるリン酸化がPINK1/Parkin経路の阻害につながるのではないかと推測した.そこで,PKAによるリン酸化修飾を受ける新規のミトコンドリアタンパク質を探索したところ,ミトコンドリア内膜タンパク質のMIC60にPKAによるリン酸化モチーフが保存されていた.MIC60はミトコンドリア内膜に局在するMICOS(mitochondrial contact site and cristae organizing system)複合体の主要サブユニットであり,ミトコンドリア内膜のクリステ構造の維持に重要な役割を果たす14, 15).細胞内におけるMIC60のリン酸化について調べたところ,フォルスコリンの処理によってMIC60のリン酸化が検出された(図3A).また,LC-MS解析により528番目のセリン残基のリン酸化を確認した.
2)MIC60はPINK1とParkinの活性化に重要である
これまで,ミトコンドリア外膜上で機能するPINK1やParkinの活性について,ミトコンドリア内膜因子の関与は知られておらず,MIC60についてもその主な機能はクリステ構造の維持であると考えられてきた14).ミトコンドリア品質管理におけるMIC60の機能を調べるために,GFP-Parkinを発現するHeLa細胞において,MIC60の発現抑制を行ったところ,CCCP処理の下でもParkinはミトコンドリアに移行できず,細胞質に蓄積した(図3B).また,ウェスタンブロットによりPINK1の安定性について調べると,CCCP処理下のPINK1の量はMIC60の発現抑制によって大きく減少していた.これらの結果は,膜電位が低下したミトコンドリアにおいてPINK1が蓄積する際にMIC60が必要であることを示しており,MIC60がPINK1とParkinを介したミトコンドリアの選択的分解に関与することが明らかになった.
3)MIC60のリン酸化はParkinのミトコンドリアへの移行を抑制する
上述したように,フォルスコリンの処理によってParkinのミトコンドリア移行が阻害されたが,これはMIC60のリン酸化を介して引き起こされるのではないかと推測した.そこで,MIC60のPKAによるリン酸化部位である528番目のセリン残基について,非リン酸化変異体(S528A)や擬似リン酸化変異体(S528D, S528E)を作製し,Parkinのミトコンドリア移行への影響を解析した.MIC60の欠損下では,Parkinはミトコンドリアへ移行できなくなるが,野生型のMIC60を発現させるとParkinのミトコンドリア移行が回復した.また非リン酸化変異体(S528A)を発現させると,野生型と同様にParkinのミトコンドリア移行がみられた.一方で,擬似リン酸化変異体(S528D, S528E)を発現させた場合にはParkinはミトコンドリアへ移行することはできず,細胞質に蓄積した.これらの結果は,Parkinのミトコンドリア移行にはMIC60が必要であり,MIC60がリン酸化されるとParkinがミトコンドリアに移行できなくなることを示している(図3C).
4)MIC19もPINK1/Parkinの活性化に関与する
MICOS複合体のサブユニットの一つであるMIC19にもPKAによるリン酸化モチーフが報告されている16, 17).そこで筆者らもMIC19のリン酸化について調べたところ,フォルスコリン処理により11番目のトレオニン残基のリン酸化が確認された.MIC60と同様,MIC19の機能はMICOS複合体のサブユニットとしての,クリステ構造の維持であると考えられており,PKAによるリン酸化の役割については不明であった.MIC19の発現抑制を行いParkinの細胞内局在について解析を行ったところ,MIC19の発現抑制の下では,Parkinのミトコンドリア移行が阻害され,細胞質に蓄積した.また,MIC19欠損下によるParkinのミトコンドリア移行の阻害は,野生型のMIC19の発現により回復したが,擬似リン酸化変異体(T11D, T11E)の発現では回復できなかった(図3C).この結果は,MIC60に加えて,MIC19のPKAによるリン酸化もParkinの移行を制御していることを示している.
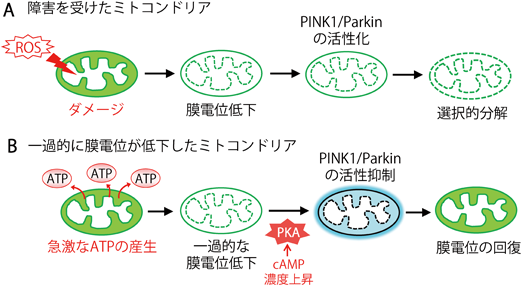
以上の結果から,MIC60とMIC19はミトコンドリア外膜におけるPINK1の蓄積に重要であり,MIC60やMIC19がPKAによってリン酸化されることで,PINK1の安定性が低下し,Parkinはミトコンドリアへ移行できなくなることが明らかになった(図3C)18).このことは,MIC60とMIC19のPKAによるリン酸化はミトコンドリア品質管理を抑制することを示しており,言い換えれば,cAMP/PKAシグナルによるリン酸化は,膜電位が低下したミトコンドリアでも分解されることなく保護される方向に働くことを意味している(図4).
5)MIC60やMIC19のリン酸化はいつ起きるのか
それでは,MIC60やMIC19はいつどのような生理的環境でPKAによるリン酸化を受けるのか,またそれは細胞機能に対してどんな意味を持つのか.この疑問に対して,筆者らはいくつかの知見を得ている.
神経細胞において,神経軸索でのミトコンドリア輸送は膜電位と相関関係があり,膜電位が維持されたミトコンドリアは細胞体からシナプスまで順行性に輸送され,逆に膜電位が低下したミトコンドリアはシナプスから細胞体まで逆行性に輸送される19).また神経細胞におけるcAMP濃度の上昇は,PKAの活性化を介して軸索伸長を促す20).神経細胞の機能においてミトコンドリアの膜電位やcAMP濃度が大きく関わっていることから,筆者らは,神経細胞でcAMP/PKAシグナルを介したミトコンドリア分解の制御が起きているのではないかと考えた.そこで,ヒト神経芽細胞腫SH-SY5Yにおいてレチノイン酸を作用させ分化を誘導すると,レチノイン酸の処理時間に伴ってMIC60のリン酸化が検出された.
この結果は,神経細胞においてMIC60やMIC19がPKAによるリン酸化を受けることで膜電位が低下したミトコンドリアの選択的分解を抑制し,神経軸索におけるミトコンドリアの効率的な輸送に貢献している可能性を示している.
神経や筋肉組織ではミトコンドリアにおけるエネルギー生産が活発に行われており,ミトコンドリアの膜電位が大きく変化する19).このような組織においてMIC60やMIC19がリン酸化されることで,一過的に膜電位が低下したミトコンドリアが分解されずに保護されている可能性が考えられる.MIC60やMIC19に加えて,ミトコンドリア品質管理に関与する新たなPKAの基質の存在も推測され,これらの因子が細胞内環境に応じてミトコンドリアの積極的な保護を行っているかもしれない.ミトコンドリア品質管理におけるPKAによるリン酸化の生理的意義の解明は,今後明らかにするべき重要な課題である.
1)MICOS複合体
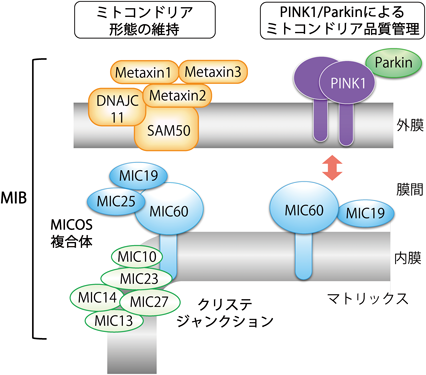
ミトコンドリア内膜は内側に陥入してクリステ構造を形成することで,内膜の表面積を増加させており,電子伝達系を介した効率的なエネルギー生産が行われている.MICOS複合体は,内膜のクリステジャンクションに位置する高分子複合体であり,哺乳類ではMICOS複合体の八つのサブユニット(MIC10, MIC13, MIC14, MIC19, MIC23, MIC25, MIC27, MIC60)が同定されている(図5)14, 21, 22).MICOS複合体は,native PAGEによる解析において約700 kDaの高分子複合体として検出されるが,この700 kDaからなるMICOS複合体は二つのサブコンプレックスから構成されており,MIC60を中心とした約450 kDaのコアコンプレックス(MIC60/MIC19/MIC25)と,MIC10を中心としたサブコンプレックス(MIC10/MIC13/MIC23/MIC27)に分けられる23, 24).
MIC60は,酵母からヒトまで広く保存されているサブユニットであり,N末端側に1回膜貫通領域を持つが,C末端側の大部分が膜間部に位置している.このC末端領域を介して,MIC60は外膜タンパク質のSAM複合体やTOM複合体と相互作用すると考えられている.MIC60を欠損させるとnative PAGEにおけるMICOS複合体のバンドは検出できなくなり,細胞においてはクリステ構造が消失しオニオン様の異常な内膜構造をとる25).また,MIC60はMICOS複合体のほぼすべてのサブユニットと相互作用しており,MIC60の欠損はすべてのサブユニットの発現量を著しく低下させることから,MIC60はMICOS複合体において中心的な役割を果たすと考えられている24).
MIC19は,膜貫通領域を持たず膜間部に局在するサブユニットであり,外膜のSAM50や内膜のMIC60と相互作用する.MIC60やMIC19の働きにより,MICOS複合体は常に外膜の因子(SAM50/Metaxin1/Metaxin2/Metaxin3/DNAJC11)と相互作用することで,2200~2800 kDaに及ぶ巨大複合体のMIB complex(mitochondrial intermembrane space bridging complex)を形成し,外膜と内膜を近接させている21, 26).
MIC60やMIC19とは異なり,MIC10はそのほとんどが膜貫通領域から構成されており,内膜に埋め込まれたトポロジーをとる.MIC10の過剰発現がクリステ構造の劇的な変化を引き起こすことや,in vitroにおけるMIC10を加えた膜再構成実験などから,MIC10が多量体を形成することでクリステジャンクションにおけるカーブを引き起こすことがわかっており,MIC60に加えてMIC10も,MICOS複合体で中心的な働きをすることがわかってきた27, 28).
MICOS複合体は,クリステ形成に加えて,タンパク質輸送やカルジオリピンの生合成,ミトコンドリアDNA(mtDNA)の維持など,その機能は広範囲に及ぶ29, 30).最近,小胞体との近接部位でMICOS複合体の生合成が行われることや,その生合成にはERMES(ER-mitochondria encounter structure)複合体が必要なことなどが報告されており,MICOS複合体の外膜や細胞質との関係性について着目されつつある23).
2)ミトコンドリア品質管理におけるMICOS複合体の役割
上述したように,MIC60とMIC19がPINK1とParkinの機能において重要な役割を果たすことがわかったが,ミトコンドリア品質管理におけるMICOS複合体の役割はこれまで知られていなかった.そこで筆者らは,MICOS複合体の他のサブユニットについても,ミトコンドリア品質管理における機能を検討した.予想外の結果に,MIC10, MIC23, MIC25, MIC27の発現抑制はParkinのミトコンドリアへの移行に影響を及ぼさず,Parkinはミトコンドリアに局在し,PINK1/Parkin経路に関与しないことがわかった.クリステジャンクションの形成に必須のMIC10でさえParkinの移行に関与しないという結果から,MICOS複合体を介したミトコンドリア形態維持とはまったく別の経路で,MIC60とMIC19は単独にPINK1の機能に関わっていることが示唆される.これと一致して,MIC60の擬似リン酸化変異体(S528D, S528E)を発現した細胞では,クリステ構造が維持されており,MIC60のSer528のリン酸化は,ミトコンドリアクリステ形態に影響を及ぼさないことがわかった.さらに,フォルスコリンを処理した細胞でもクリステ構造は維持されていた.これらの結果から,ミトコンドリア品質管理におけるMIC60とMIC19の機能は,MICOS複合体によるクリステ構造の維持とは別の,MIC60とMIC19固有の機能であると考えられる(図5).