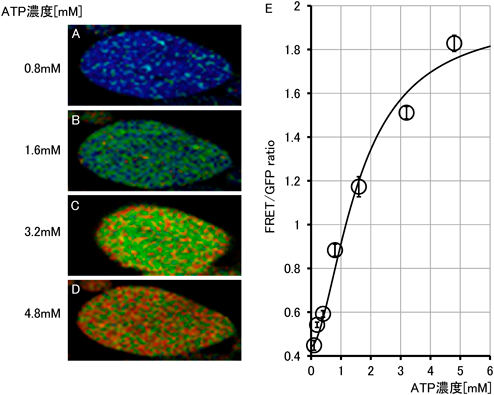
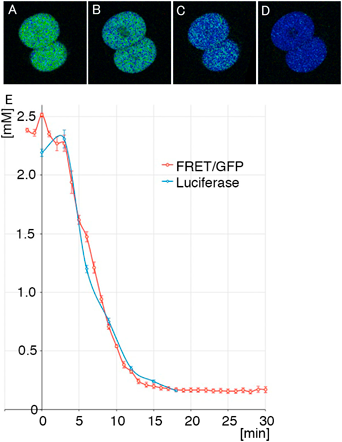
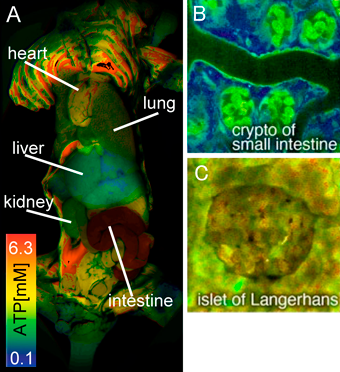
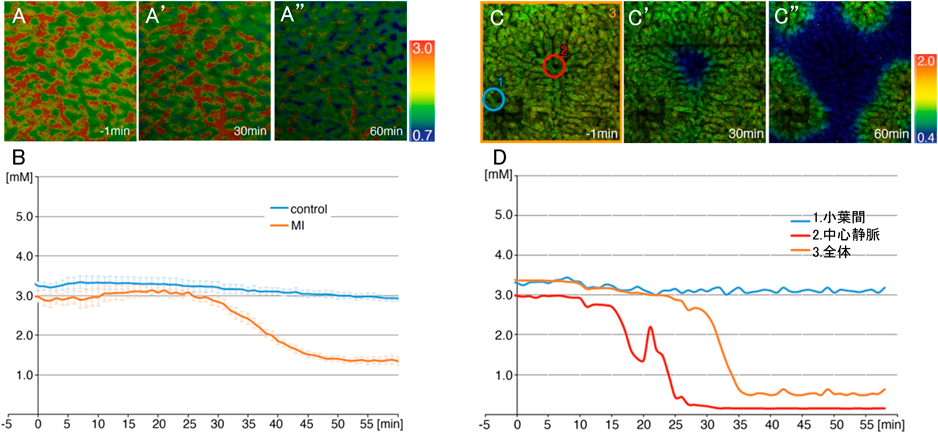
マウス生体内におけるミトコンドリアのエネルギー産生機能評価Evaluation of mitochondrial energy production in vivo
1 国立循環器病研究センター研究所研究推進支援部National Cerebral and Cardiovascular Center ◇ 〒564–8565 大阪府吹田市岸部新町6–1 ◇ 6–1 Kishibe-Shimmachi, Suita, Osaka 564–8565, Japan
2 富山県立大学生物・医薬品工学専攻Department of Pharmaceutical Engineering, Faculty of Engineering, Toyama Prefectural University ◇ 〒939–0398 富山県射水市黒河5180 ◇ 5180 Kurokawa, Imizu, Toyama 939–0398, Japan