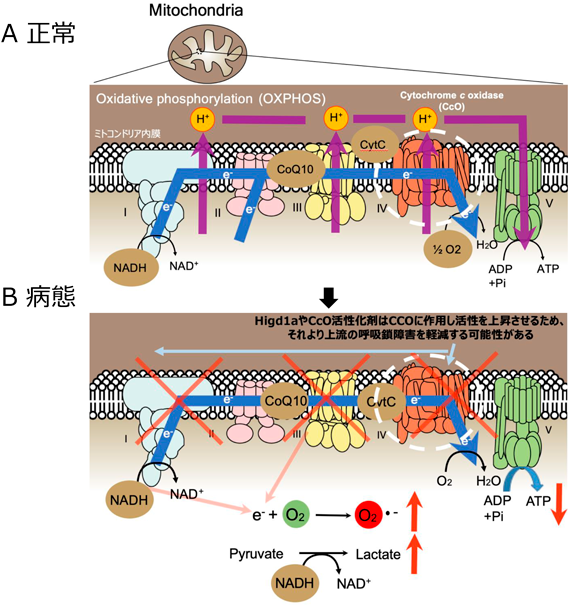
ミトコンドリアは真核細胞が使用するATPのほとんどを合成する細胞小器官である.合計5個の酵素複合体がミトコンドリア内膜に存在し,チトクロムcオキシダーゼ(cytochrome c oxidase:CcO)は呼吸鎖,電子伝達系の最後に位置する酵素複合体である(図1).電子伝達,酸化的リン酸化によるエネルギー産生の機能不全は,ミトコンドリア病をはじめとする多くのヒト疾患で認められる.
我々のグループは,低酸素で誘導される遺伝子に内因性の臓器保護的な作用があるのではないかと考え,心筋細胞を用いて遺伝子の探索を行った.一過性に発現が誘導される分子のなかから,ミトコンドリアに局在するHigd1aに着目し,その結合分子としてCcOを同定した.大腸菌を用いて発現精製したリコンビナントHigd1aはCcOに直接結合し,その酵素活性を2倍以上に上昇させた1).
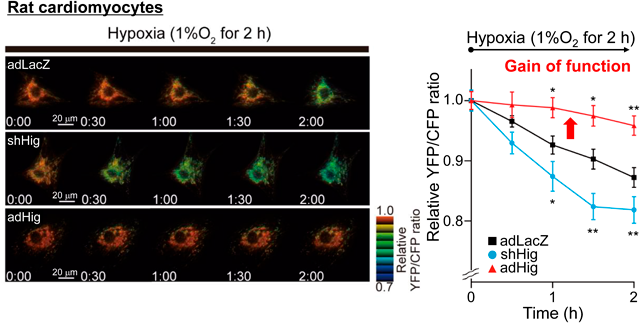
Higd1aによるCcOの活性化が,培養細胞でも実際に呼吸鎖活性の上昇,そしてATP合成の上昇につながるかどうかMit-ATeamを用いて検討した.ATeamはATPと結合するipsilonサブユニットをCFP, YFP変異体で挟んだFRETプローブで,ATP結合によりコンホメーション変化が起こりFRETシグナルが検出される.このプローブにミトコンドリア局在シグナルを付加し,ミトコンドリアのATP濃度をモニターすることが可能となる2, 3).擬似カラーをつけた画像では赤系はATP濃度が高く,青系はATP濃度が低いことを示す.このMit-ATeamを心筋細胞で発現させ,低酸素に曝露すると経時的にミトコンドリアATPの低下がみられたが,Higd1aをノックダウンするとこの低下がさらに増悪し,逆にHigd1aの過剰発現により低酸素下でのATPの低下が抑制され,細胞保護効果を示した(図2).
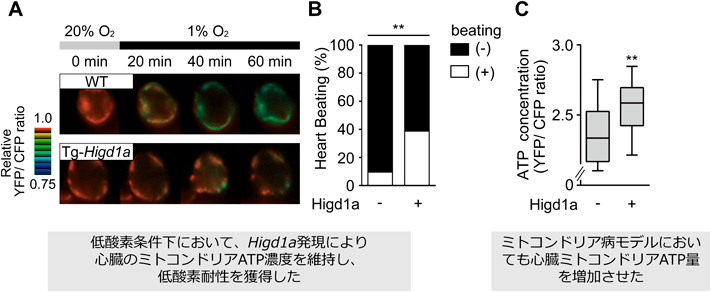
次にHigd1aのin vivoにおける臓器保護効果を,ゼブラフィッシュを用いて検証した.Mit-ATeamを心臓に発現するゼブラフィッシュを構築し,その稚魚に低酸素刺激(1%酸素濃度)を加え,ATP濃度の変化と心臓の低酸素耐性を評価した.心臓においてHigd1aを過剰発現するゼブラフィッシュでは,コントロールと比較してミトコンドリアATP濃度が維持され,低酸素下でも心臓の拍動が保たれる個体数の有意な増加,すなわち臓器保護効果を認めた(図3A, B).次に,呼吸鎖複合体III(Complex III)の阻害剤であるAntimycin Aを用いて,呼吸鎖障害モデルを作製し,Higd1aの臓器保護効果を検討した.Mit-ATeamによる心臓ATP濃度の測定と生存率の検討を行った結果,Higd1aを過剰発現させた個体では,ミトコンドリアATP濃度が有意に高く(図3C),さらに生存率の上昇を認めた4).これらの結果より,ミトコンドリア病モデル動物においても,CcOの活性上昇が効果的であることを証明した.
このようにHigd1aは動的に酸化的リン酸化酵素の機能を制御し,ATP産生能を上げ,臓器機能を改善させる現在のところほとんど唯一のタンパク質であり,創薬標的としてきわめてユニークである.ではHidg1aによるCcO活性化は,どのようなメカニズムで引き起こされるのであろうか?
精製したリコンビナントHigd1aはCcOに直接結合し,その酵素活性を2倍以上に上昇させる.この条件で,CcOの可視光領域のヘム吸光帯の変化がみられ,同波長励起による共鳴ラマン法により,CcOの活性中心heme a周辺の構造変化が起こることが明らかとなった1).次に生化学的に酵素反応パラメーターを検討したところ,Higd1aの結合により最大反応速度は上昇するが,CcOとその基質であるチトクロムcとの親和性を表すミカエリスメンテン係数はほぼ変化なく,基質の結合に影響を与えない,というものであった4).
これらの事実は,Higd1aはアロステリックmodulatorとして,CcOの構造変化を介して活性を上昇させることを意味している.CcOを含む電子伝達,酸化的リン酸化は,活性酸素種(reactive oxygen species:ROS)の発生を最小限にして,高エネルギーの電子流を高効率でATPへ変換するため,ミトコンドリア内膜に堅牢な構造を持つと考えられていた.しかしHigd1aの発見は,酸化的リン酸化を担うタンパク質複合体に内因性に活性が制御される構造的基盤が存在することを示唆するものであった.
2. ミトコンドリア病治療薬開発を目指した化合物スクリーニング
ミトコンドリア病は特定疾患に指定される難病であり,ミトコンドリア呼吸鎖異常症(mitochondrial respiratory chain disorder:MRCD)とほぼ同義である.MRCDは,名前がその病態の本質をとらえているように,呼吸鎖・電子伝達系の機能不全が原因の疾患群である.ATP合成の低下,ROSの増大,代償性の解糖系上昇による乳酸アシドーシスなどが,複合的に細胞障害,組織機能低下を引き起こすと考えられている(図1).
次世代シークエンサーの普及とともにその原因となる遺伝子異常が次々と明らかにされ,2000年以前に考えられていたようなミトコンドリアDNAの異常のみならず,それよりもはるかに多い核遺伝子の異常が発見され,現在300を超える病因遺伝子が同定されている.このことは,ミトコンドリア病が先天性代謝疾患のなかで最も患者数が多い遺伝病であること(4300出生に1人)5),またその病態が症例により異なり,不均一であることを意味する.
しかしながらミトコンドリア病の治療は,十分に確立されているとはいえない.これまで補酵素の補充や,抗酸化薬を用いた臨床試験はことごとく失敗に終わり,有効な治療薬開発が切望されている.その中で,わが国において本年タウリン大量投与が承認されたことは,非常に喜ばしいニュースである.しかしタウリン大量療法の有効性が期待されるのは,特定のミトコンドリアDNA変異を持つ患者群である.上述したようにミトコンドリア病は,ヘテロな病態のために多くの異常が混在しており,個々の原因,病態にあわせ,標的の異なる治療選択肢の拡充,充実が求められる.
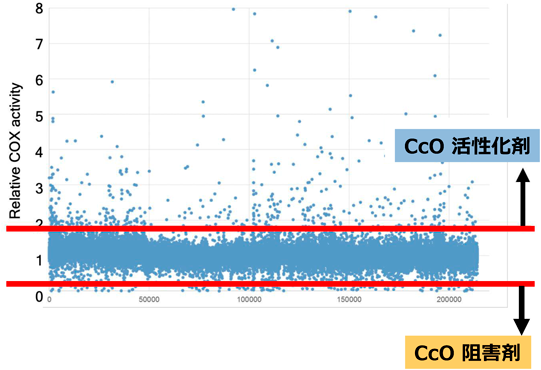
Higd1aの研究から,CcOには内因性に活性が制御される構造的基盤が存在すること,そのポケットを低分子化合物で刺激することができれば,治療薬開発につながる可能性が期待された.そこでウシ心臓から精製し,いったん微結晶を作製したあと溶解した精製度の高いCcOを用いてin vitro活性測定系を構築し,約20万種類の低分子化合物についてCcO活性調節剤のハイスループットスクリーニングを行った(図4).複数のヒット化合物について,正常細胞,ミトコンドリア病モデル細胞を用いた二次以降のスクリーニングを進め,複数の候補活性化剤の取得に成功した.候補化合物はミトコンドリア病患者由来細胞で呼吸鎖活性の上昇と細胞保護効果を示し,電子伝達の改善がミトコンドリア病の治療につながる,というコンセプトを確立した.さらに理化学研究所の創薬化学基盤ユニットとの共同研究により化合物の新規合成を進め,活性の増強,マウス体内動態の検討,マウスモデルを使った検証を進めている.
本研究の標的は新規であり,開発に成功すればFirst in Classのミトコンドリア病および代謝病治療薬となる.またミトコンドリア機能異常は神経変性疾患や糖尿病をはじめとした代謝疾患,心不全,動脈硬化などの循環器疾患,悪性腫瘍でさえ関連が指摘されており,多くのヒト疾患への適用も期待できる.繰り返しになるが,ミトコンドリア病は難病であり,その病態は多様である.現在わが国をはじめ多くの研究者らがアンメットメディカルニーズの大きなミトコンドリア病の治療薬開発を進めている.安全であることを前提としてではあるが,作用点の異なる新規治療薬の開発は,併用による相加,相乗効果を期待できる可能性もあり,positiveな創薬開発が進むことを切に願う.
3. 呼吸鎖酵素に保存されたアロステリック部位を利用した抗菌剤の開発
1)薬剤耐性問題と呼吸鎖
薬剤耐性(antimicrobial resistance:AMR)は世界保健の最重要課題の一つである.このまま何も有効な対策がとられないと2050年にAMRによる年間死亡者数ががんによる死亡を抜いて全世界で1000万人を超え,社会的,経済的にも大きな損失となることが予測された6).薬剤耐性が形成されるメカニズムは,抗生剤に対する耐性遺伝子変異の獲得のみならず,エネルギー代謝の多様性や,バイオフィルムの形成による抗生物質の不達,抗菌剤の排出機構など複合的な要素で形成される.そのためその対策には,病原菌の生存・適応戦略や,宿主の防御機構を含めた病態の理解が必要である.また従来の抗菌剤の標的は,細胞壁合成阻害や核酸合成阻害など増殖期に有効であるが,非結核性抗酸菌や緑膿菌のようにバイオフィルム中で休止期となるような菌は消失させることが困難であるため,休止期病原菌にも有効な新規メカニズムによる抗菌剤の開発が強く求められている.
冒頭で述べたように真核生物のもつミトコンドリアは,約20億年前に好気性細菌であるαプロテオバクテリアが古細菌に取り込まれ,細胞内共生を成立させて進化をとげてきた細胞小器官である.αプロテオバクテリアの呼吸鎖は細菌,古細菌にも広く伝播しており,真核生物を含む生命の3ドメインに保存される基本的な生体エネルギー産生機構である.呼吸鎖に引き続くATP合成酵素を標的とするベダキリンが,結核菌感染症領域で40年ぶりに新規承認薬となったことは,呼吸鎖・エネルギー産生系が休止期の病原菌の生存にも必須の機構であることを意味し,抗菌剤の創薬標的として妥当であることを証明するものである7, 8).これまでに結核菌のみならず,真菌症,寄生虫感染症においても呼吸鎖を標的とした化合物が臨床試験や承認に開発されている9–11).
2)抗菌剤としてのアロステリック阻害剤開発の課題
しかしながら,上記呼吸鎖を標的とした化合物のほとんどが,基質結合部に対する拮抗阻害剤であることは注意すべき点である.呼吸鎖・エネルギー産生系は,細菌から真核生物まで広く保存される細胞の生存にとって根本的な機構であるがゆえに,呼吸鎖酵素のタンパク質構造,特に基質結合部位である活性中心を含むコアの構造の保存性が高い.また基質であるチトクロムcやユビキノールが共通であるため,基質結合部に対する拮抗阻害剤は,複数の菌種の酵素を阻害する広域スペクトラムを呈する可能性が高く,新たなAMRを発生させる誘因となること,さらに宿主であるヒトタンパク質との交叉反応による副作用も懸念される.実際に,先述のベダキリンは真核生物のATP合成酵素への交叉性が懸念されて,心毒性を中心とする副作用のため,高度薬剤耐性菌に限っての使用に制限されている12).そのため,基質結合部位を標的としない,アロステリック阻害剤の開発がより望ましい.一般にアロステリック部位は,種間の配列保存性は低く,そのため高い選択性と安全性が期待されるためである.この高い選択性は,拮抗阻害剤に比べて狭いスペクトラムの抗菌剤の開発を可能とし,選択性が高く,宿主の常在細菌叢を乱さない抗菌剤が望まれるAMR対策のニーズにより適している.
しかしながら,アロステリック部位の探索は,標的酵素に対する地道な生化学的アプローチで行われることがほとんどであり,系統的かつ網羅的な探索法は確立していない.分子動力学計算(molecular dynamics:MD)を用いてアロステリック部位を探索する方法も提案されているが,特に呼吸鎖酵素のほとんどは膜タンパク質であり,計算化学的手法の難易度はさらに上がるため,呼吸鎖酵素を標的としたアロステリック阻害剤の探索は非常に困難である.
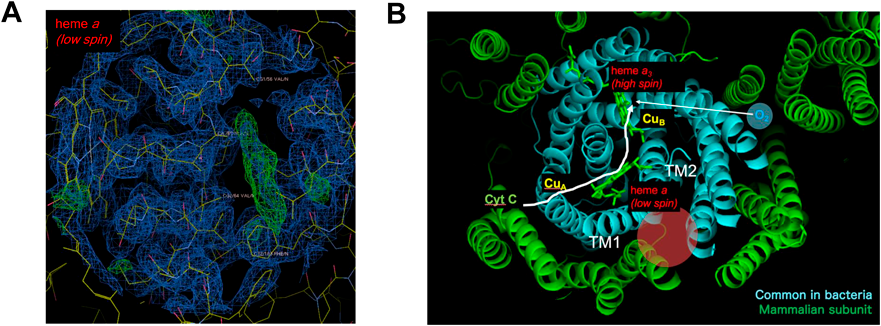
ミトコンドリアCcO(mtCcO)は,呼吸鎖の終末に位置する酸化酵素であり,ヒトでは13種のサブユニットから構成される複合体である.このうちミトコンドリアDNAでコードされる三つのサブユニット(subunit I~III)は原核生物である細菌から真核生物であるヒトまで広く保存されており,ヘム銅オキシダーゼ(heme copper oxidoreductase:HCOs)と呼ばれるスーパーファミリーを形成する.ヒトのHCOすなわちmtCcOでは細菌のHCOが持たない10個のサブユニットが存在するが,それらの役割は不明な点が多い.膜タンパク質ではないが,リボソームやRNAポリメラーゼといった生物の生存にとって必須の酵素も,コアの構造は原核生物から真核生物まで広く保存されているが,ヒトや哺乳類では付加的なサブユニットが加わり,タンパク質のサイズも巨大化している.興味深いことに,リボソームやRNAポリメラーゼにおけるこれらのサブユニットの一部には酵素の機能調節が報告されている13, 14).そこで我々は,「HCOすべてに共通に保たれるコア構造と哺乳類が有するサブユニットとの境界面にアロステリック活性調節部位が存在するのではないか?」と仮説をたてた.そういったアロステリック活性調節部位を見つけることができれば,哺乳類のみが有するサブユニットにより,アロステリック部位の構造は細菌と哺乳類酵素では大きく異なることが予想され,細菌の酵素特異的な化合物の創出,ひいては特異性の高い抗菌剤の開発が可能となるはずである.
3)mtCcOアロステリック阻害剤の結合部位の同定
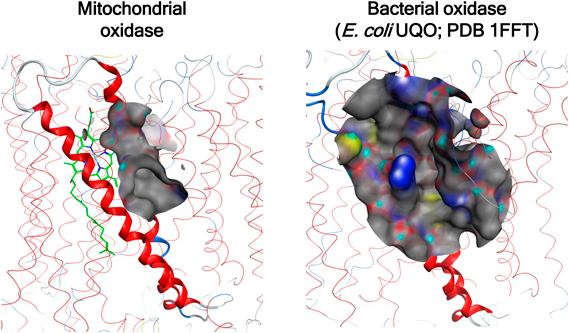
この仮説を実験的に検証するため,まず条件に合致するアロステリック部位を探索することが必須である.図4のランダムスクリーニングにより得られたmtCcOの活性調節化合物のなかから,酵素反応パラメーター測定により,アロステリック阻害剤と予想される化合物をまず選出した.これらの阻害剤をmtCcOの結晶にソーキングし,X線構造解析により順次結合部位の同定を進めたところ,T113と名づけた化合物の結合部位が非常に興味深いものであった.結晶構造解析で同定された化合物の結合部位は,哺乳類mtCcOだけに存在する核ゲノムでコードされるヘリックス(図5A, B)により,外側を覆うように囲まれ,タンパク質内部に埋め込まれていた(図6).化合物結合部位はmtCcOに二つ存在するヘムからも離れており,またチトクロムcからの電子伝達経路や,もう一つの基質である酸素の通り道とも異なり,その結合部位からもT113がアロステリック阻害剤であることを確認した(図5B).
化合物結合部位を囲む4本のヘリックスのうち,3本はsubunit Iであり(図5, B),細菌のHCOにも共通に存在する.さらに低スピンヘムとこの3本のヘリックスの位置関係・立体配座は,これまでに構造が明らかとなっている,真核生物,細菌を含めたすべてのHCOsにおいて保存されていた.このことは,mtCcOの阻害剤の誘導体は,立体配座が保存されている細菌のHCOの同部位に結合する可能性が高いと考えられる.しかしながら,化合物結合部位の表面構造はmtCcOのみに存在するヘリックスの存在により異なるため(図6),細菌のHCO特異的な阻害剤が創出できることが期待された.
4)細菌のHCO特異的な阻害剤の探索
そこで理化学研究所制御分子設計研究チームの本間,幸らと共同研究にて,T113を含む四つの阻害剤の類縁体をin silicoで選出,あるいはT113結合部位にドッキングシミュレーションで結合が予想される化合物を選出し,合計551個のmtCcO阻害剤の誘導体カスタムライブラリーを独自に作製した.仮説の検証を進めるため,細菌のHCOとして,大腸菌ユビキノールオキシダーゼ(E. coli ubiquinol oxidase:Eco UqO)を用いた.カスタムライブラリーを,精製したEco UqOに対してスクリーニングすると,阻害率40%以上を示すヒット化合物が19個取得できた.当初の仮説どおり,mtCcOとEco UqOの両方に共通に阻害活性を示す化合物や,Eco UqOに特異的な阻害剤(N4)の取得に成功した.N4は,酵素反応パラメーターの解析により,予想どおりアロステリック阻害モードを示した.より直接的な証拠を得るために,N4とEco UqOの複合体構造をクライオ電子顕微鏡により決定し,実際に低スピンヘムと3本のヘリックスで囲まれ,表面に露出している細菌のHCO型のアロステリック部位にN4が結合していることを証明した.
これまでに複数の菌種の酸化還元酵素を検証し,菌の酵素特異的な阻害剤の同定に成功した.すなわち我々の戦略により,狭いスペクトラムの抗菌剤の開発が可能であることが示唆されており,これは宿主の常在細菌叢を乱さないAMR対策として強く求められている要件に合致している15).現在我々の研究室では,薬剤耐性菌対策として新規メカニズムによる緑膿菌および淋菌に対する抗菌剤の開発を進めている.