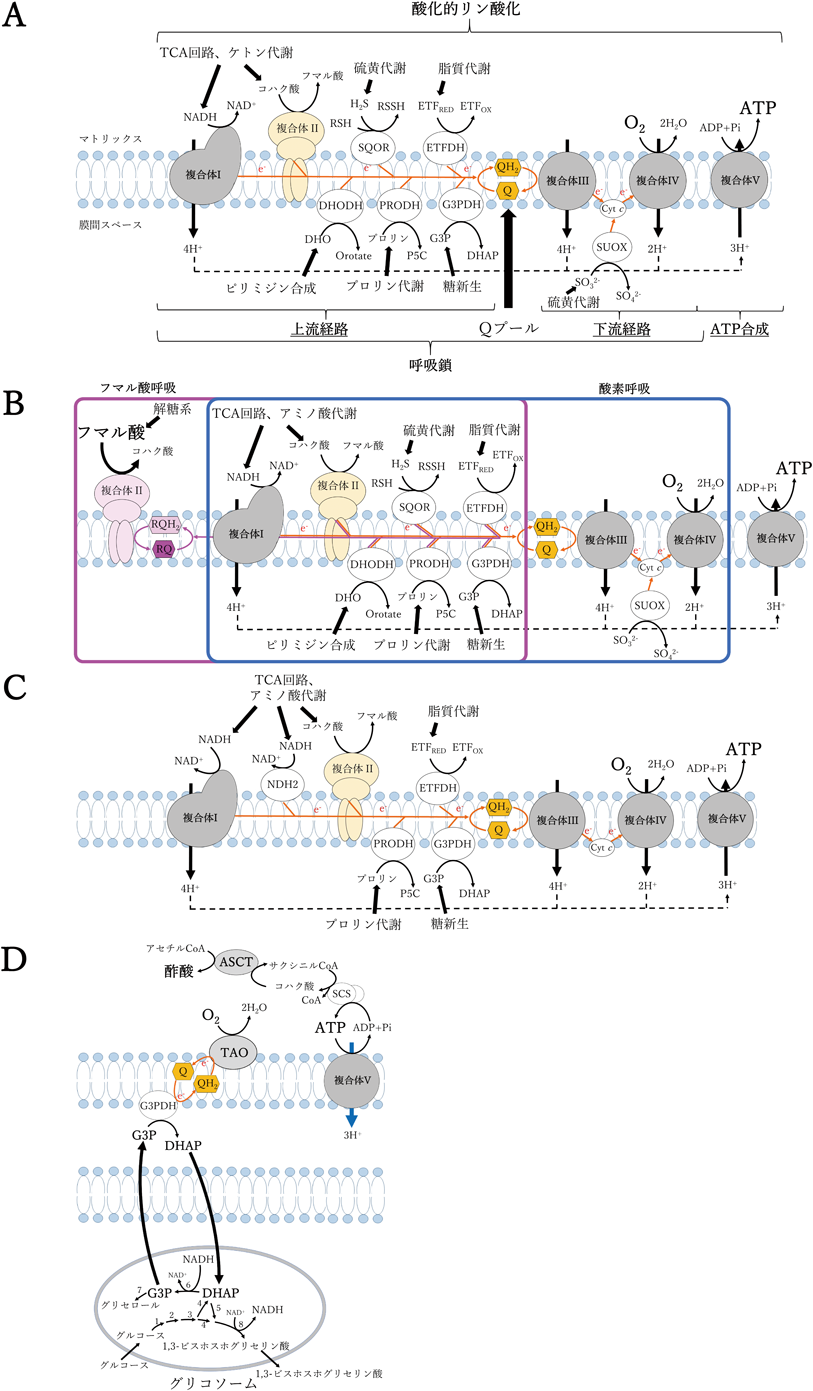
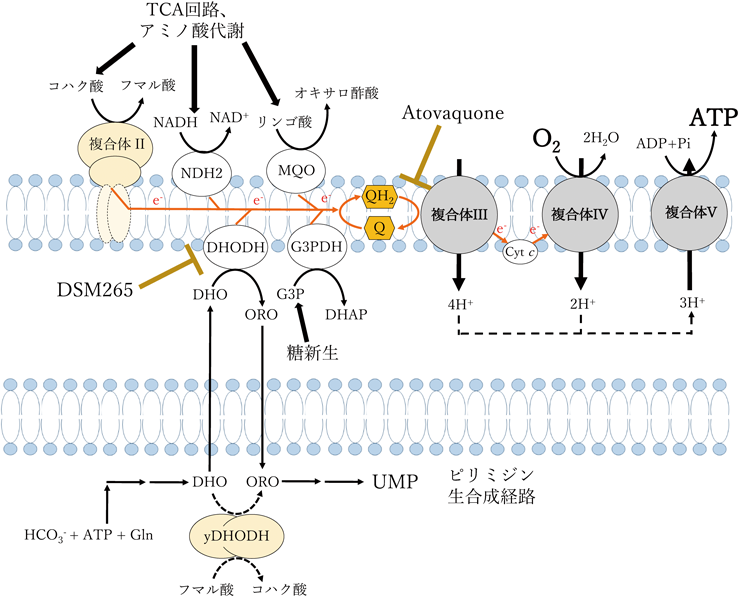
ミトコンドリアは,20億年前にαプロテオバクテリアが真核細胞に共生し,その結果誕生した細胞小器官の一つであると考えられている.そして,共進化の過程で細菌由来DNAの大部分が宿主である真核細胞の核に転移したため,現在のミトコンドリア(mt)DNAは共生初期の細菌が持っていたDNAの1割程度しか残っていないにもかかわらず,mtDNAの複製,修復そして転写は生命の維持に必要不可欠である.ミトコンドリアの主要な機能は酸化的リン酸化によるATP合成であり,NADH,コハク酸やジヒドロオロト酸などの基質から酸素への電子伝達を行う呼吸鎖とATP合成酵素から構成されている.さらに,呼吸鎖はユビキノン(Qプール)を挟んで,「上流経路」と「下流経路」に分けられる(図1A).ヒトのmtDNAは,呼吸鎖複合体I, III, IV, Vのサブユニットを合計13種類,tRNAを22種類,12Sおよび16SリボソームRNAをコードしており,生物のエネルギー転換系において,重要な役割を担う1).脊椎動物のmtDNAのサイズは15~20 kbであるのに対し,マラリア原虫など住血胞子虫目の寄生性原生生物(Plasmodium属原虫とその近縁種)は6 kbという最も小さいmtDNAを持つのにもかかわらず,複合体III(cob)と複合体IV(cox1/cox3)の3種類の遺伝子が残っていることから,cytochrome c(Cyt c)の酸化還元をミトコンドリアで制御する重要性が想定できる2).
寄生虫はすべて真核生物であり,多細胞の蠕虫から単細胞の原虫まで生物学的にきわめて多様な生活環,寄生様式と寄生適応戦略を持っている.さらに,中間宿主・終宿主(一部では自由生活期)において代謝経路を巧妙に変化させ,各環境に適応するためには寄生虫のミトコンドリアが深く関わっている.たとえば,宿主である哺乳類の呼吸鎖は上流経路の電子を下流経路の複合体IIIとIVを介し酸素に伝達する「酸素呼吸」を行う(図1A).一方,腸管腔内の酸素濃度は2.5~5%と低く,腸管に寄生するエキノコックス(条虫)や回虫(線虫)の成虫期では上流経路の電子をフマル酸に伝達する「フマル酸呼吸」を行う3–5).このミトコンドリア型フマル酸呼吸は複合体IIの逆反応(quinol:fumarate reductase:QFR),低電位キノン(rhodoquinone:RQ)とキノン還元酵素群(複合体Iやジヒドロオロト酸脱水素酵素)から構成されている(図1B).さらに,腸管膜静脈に寄生するマンソン住血吸虫の成虫や肝臓に寄生するエキノコックスのシスト(原頭節)では,酸素呼吸とフマル酸呼吸の両方を行うハイブリッド型の呼吸鎖を持ち,生育環境の酸素の供給量によって使い分けていることが考えられる(図1B)5, 6).フマル酸呼吸は一部の原虫でも観察されており,マラリア原虫(Plasmodium falciparum)7)とニワトリコクシジウム症を引き起こすEimeria tenella8)から精製したミトコンドリアでは,酸素呼吸阻害時(シアン存在下)にフマル酸依存的なNADHの再酸化が検出できる.
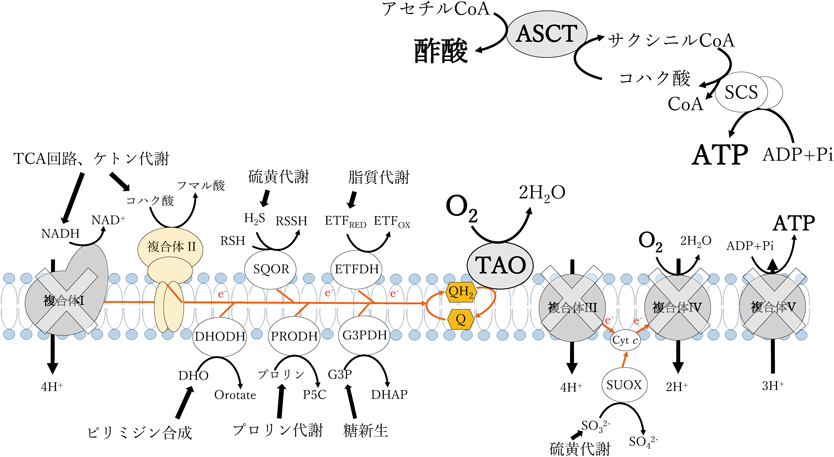
アフリカ睡眠病を引き起こすブルーストリパノソーマ(Trypanosoma brucei rhodesienseとT. b. gambiense)は,媒介昆虫内(プロサイクリック型;PCF)では,ミトコンドリア下流経路は哺乳類と同様な複合体III–IVを介した酸素呼吸と酸化的リン酸化を行っている(図1C).一方,宿主哺乳類内の血流型(BSF)では,複合体III–IVが消失し,プロトンポンプ活性を持たないシアン耐性末端酸化酵素(trypanosome alternative oxidase:TAO)が唯一のキノール酸化を担う酵素となる(図1D).また呼吸鎖上流には,解糖系で生じるNADHの再酸化を保つために必要なユビキノン依存的なグリセロール-3リン酸脱水素酵素(UQ-G3PDH)のみが残る(図1D)9).さらに,BSFのミトコンドリアにはプロトンポンプ機能を持つ酵素が存在しないため,ATP産生は酸化的リン酸化から基質レベルのリン酸化によって行われる.宿主の場合,酢酸は細胞質で生成され,脂肪酸合成に用いられる.一方,トリパノソーマのミトコンドリアには酢酸:コハク酸CoA転移酵素(ASCT)とサクシニルCoA合成酵素(SCS)が共役してASCT/SCSサイクルを形成し,基質レベルのリン酸化で酢酸とATPを合成している10)(図1D).そして,トリパノソーマはこのATPを利用して複合体V(ATP合成酵素)の逆反応によりプロトンを排出し,ミトコンドリアの電気化学的勾配を維持していることが明らかになりつつある(図1D).
上記に述べたように,ミトコンドリア呼吸鎖上流経路,下流経路,ATP生産経路は多様であり,時には格好の創薬標的になる.ヒトのde novoピリミジン生合成経路の第4ステップを触媒するジヒドロオロト酸脱水素酵素(HsDHODH)はジヒドロオロト酸の還元力を呼吸鎖ユビキノンに伝達する(図1A).通常,ヒト細胞はピリミジンをde novoとsalvageの2経路から得ることができる.しかし,活性化した免疫細胞(T/B細胞),がん細胞やウイルス感染細胞では,ピリミジンを得るためにsalvage経路では不十分でありde novo経路を増加させる11).そのため,HsDHODH阻害剤は正常細胞に対しほとんど毒性を示さないが,その薬効は免疫抑制,抗がん,抗ウイルスと広域スペクトルである.実際,リウマチ薬として用いられているArava®(Sanofi社)の主成分leflunomideは,体内でteriflunomideに代謝され,HsDHODHを阻害しその免疫抑制作用によって薬効を発揮する12).感染症創薬に関しては,2016年にFDAに認可された抗結核薬のbedaquilineは,結核菌のATP合成酵素が標的である13).また,抗マラリア薬のatovaquoneや抗コクシジウム薬のdecoquinateは寄生虫の複合体IIIを特異的に阻害する14, 15).さらに,開発中の抗トリパノソーマ薬のascofuranoneはTAOをきわめて低濃度で阻害する16, 17).上記に述べたように,酸化的リン酸化や呼吸鎖が創薬標的になるのは病原体も同様である.以下の節では,各々の寄生虫のミトコンドリア多様性を標的にした創薬研究と,寄生虫の酵素をツールとしたミトコンドリア病発症機構の研究について紹介する.
2. 住血吸虫のミトコンドリア呼吸鎖を標的にした創薬
1)住血吸虫症
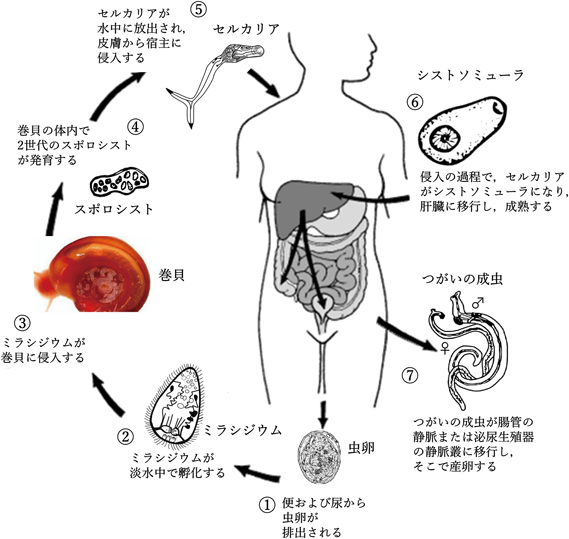
住血吸虫症は世界中で2億人以上が感染し,10億人の人々が感染の危険にさらされており,WHOが指定する「顧みられない熱帯病(neglected tropical diseases:NTDs)」の一つである18).マンソン住血吸虫(Schistosoma mansoni),日本住血吸虫(S. japonicum)およびビルハルツ住血吸虫(S. haematobium)がアフリカや中南米,またアジアで多大な健康被害と社会的経済的損失を与えている19).マンソン住血吸虫の生活環はヒトを含めた哺乳類終宿主と中間宿主である淡水産巻貝(Biomphalaria属)の間で維持されている.まず,ミラシジウム包蔵卵が糞便とともに排泄され,水中で孵化しミラシジウムが放出される.ミラシジウムは巻貝に侵入し,スポロシストに分化する.数週間後,感染巻貝から淡水中に放出されたセルカリアは,ヒトをはじめとする哺乳動物に経皮的に侵入し,肺(シストソミューラ),門脈(成虫)の順に移行し,肝類洞で雌雄が一対となり最終的に腸間膜静脈に移動し,毛細血管内に産卵された虫卵は,炎症を誘導し,腸管の出血・壊死を引き起こし腸管腔へ排出される(図2).
マンソン住血吸虫は好気条件(ミラシジウム,セルカリア)および低酸素条件(シストソミューラ<腸間膜静脈系<虫卵)の双方に適応しつつ発育する寄生虫である.環境中の酸素分圧の変化に適応する寄生戦略に関しては,回虫やエキノコックスを用いた研究から,フマル酸呼吸の存在が明らかになっている4, 5).一方,住血吸虫に関してはそのエネルギー代謝の詳細は不明なままである.これは住血吸虫の研究には貝と宿主の維持が必要で,一般の実験室では困難であることに起因している.住血吸虫症に対するワクチンはなく,治療薬としては,プラジカンテル(PZQ)のみが使用されており,成虫には効果があるが,シストソミューラにはまったく無効なため,感染予防効果は期待できない6).さらに,流行地ではPZQ耐性が報告されており20),新規な治療薬と感染予防薬の開発が求められている.
2)マンソン住血吸虫のミトコンドリア
マンソン住血吸虫は,淡水産巻貝,淡水,哺乳類,糞便といった劇的に変化する環境に速やかに適応しつつ生活環を維持する.マンソン住血吸虫各ステージ(ミラシジウム,スポロシスト,セルカリア,成虫)のミトコンドリアからはフマル酸還元活性とRQ/ubiquinone(UQ)が検出されることから21),ほとんどのステージにおいて酸素呼吸とフマル酸呼吸のスイッチを自由に行うハイブリッド型ミトコンドリア呼吸鎖を持ち,環境中の酸素濃度変化に対し巧妙に適応することが推測できる.呼吸鎖下流に位置する複合体III–IVは電気化学的勾配の形成と維持の他に,呼吸鎖上流の経路を促進するために必要である(図1A~D).マンソン住血吸虫のゲノム情報から,呼吸鎖上流に位置する複合体IとIIの他にDHODH(Smp_078730),グリセロール3-リン酸脱水素酵素(G3PDH;Smp_121990),スルフィド:キノン酸化還元酵素(SQOR;Smp_062070)とプロリン脱水素酵素(PRODH;Smp_170690)の存在が確認できる(図1C)22).上記酵素のうち,生化学的解析が唯一進んでいるのはDHODHであり,創薬標的候補の一つとされている23).
3)マンソン住血吸虫の呼吸鎖を標的にした創薬研究
マンソン住血吸虫の成虫において,酸素・フマル酸呼吸は創薬標的であることが示唆されてきたが24),淡水(セルカリア)から感染初期(シストソミューラ)のステージ移行においてはわかっていない.マンソン住血吸虫では創薬標的の遺伝学的バリデーションに使用される遺伝子ノックアウトの手法は確立されていないが,阻害剤を用いたケミカルバリデーションが利用可能である.マンソン住血吸虫は巻貝とマウスを用いて実験室(BSL2Aレベル)でその生活環を維持することができる(図2).そして,住血吸虫の各ステージを用いて,目視で運動性をスコアリングする化合物評価系を用いてさまざまな生物の呼吸鎖やミトコンドリア機能の阻害剤(116種類)に対し評価を行った6).この方法は主観的ではあるが,高価な機材や試薬は必要なく,実体顕微鏡さえあれば化合物の評価ができるメリットがある.
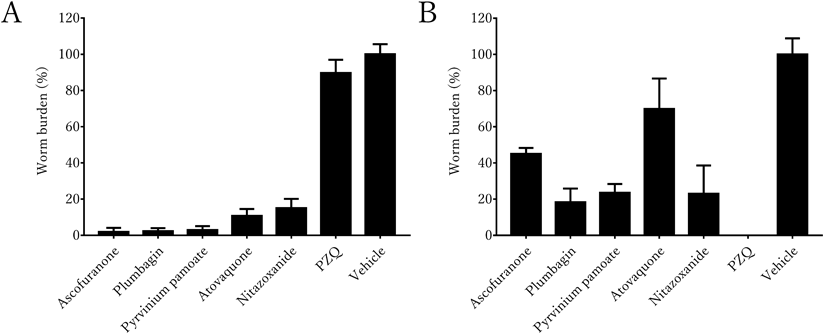
まず,セルカリアは複合体Iの阻害剤(rotenone)により,運動性が完全に阻害された.一方,典型的な複合体II(atpenin A5)と複合体III(antimycin A, azoxystrobinとmyxothiazol)阻害剤に耐性を示した.そして,複合体IとIIを阻害するpyrvinium pamoate(PP)と複合体IIとIIIを阻害するferulenol, atovaquone(ATQ)とascofuranone(AF)に対し高い感受性を示した6).すなわち,感染する前のセルカリアにおいては,複合体IによるNADH再酸化系はきわめて重要であり,酸素呼吸またはフマル酸呼吸のどちらかが機能さえしていれば,運動性に影響はないと考えられる.
次に,セルカリアをマウスに感染させ呼吸鎖阻害剤の感染防御効果を評価した.化合物の投与は1日1回とし,感染前日から感染後3日の合計4日間続けた.最後の投与から4日後(感染後1週間)にマウスから肺を摘出し,シストソミューラの回収率をWorm Burden(WoB)として評価した.治療薬のPZQのWoBは89.6%であり,予想どおり感染予防効果は示さなかった.一方,AF, ATQ, PP投与群のWoBは順に1.9%,10.8%と2.9%と低く,特にAFが最も高い予防効果を示した(図3)6).この,結果はセルカリアの結果と一致しており,シストソミューラの体内移行にはミトコンドリア呼吸鎖が必須であることが明らかになった.
次に呼吸鎖阻害剤の治療効果を感染6週間後のマウスを用いて評価した.化合物の投与は1日1回×4日間行い,最後の投与から14日後に感染マウスの門脈からPBSを灌流し,成虫のWoBを評価した.陽性コントロールのPZQ治療群ではWoBが0%となり,高い治療効果を示した.そして,AF, ATQ, PP投与群のWoBは45.0%,69.9%,23.6%であった(図3)6).非治療群(vehicle)と比較し有意に治療効果を示したが,薬効が限定的であり,マンソン住血吸虫の成虫では,複合体I, II, IIIに依存しないエネルギー生産系を有する可能性を示している.興味深いことに,マンソン住血吸虫のゲノムには,Qプールの下流に位置し,Cyt cに電子を伝達する亜硫酸酸化酵素(SUOX;Smp_048310)が保存されている.成虫でSUOXが機能していれば,複合体I, II, IIIからの電子伝達が阻害されても,亜硫酸からの電子が「Cyt c→複合体IV→酸素」の順に伝達され,複合体IVにより電気化学的勾配を形成し,複合体VによりATPを合成すると仮定できる.亜硫酸は食品から摂取できるうえに硫化水素の代謝産物である.生体内では亜硫酸は小腸で取り込まれ,腸管膜静脈に輸送され肝臓で代謝される.さらに,腸管内の硫黄還元細菌により硫化水素が生成され(腸管は最も硫化水素濃度が高い臓器である),亜硫酸と同様に取り込まれ肝臓で代謝される.このように,マンソン住血吸虫成虫(雄雌)が寄生する部位の腸間膜静脈では,硫化水素も亜硫酸も豊富に存在すると考えられ,今回紹介した結果と仮説を支持している.
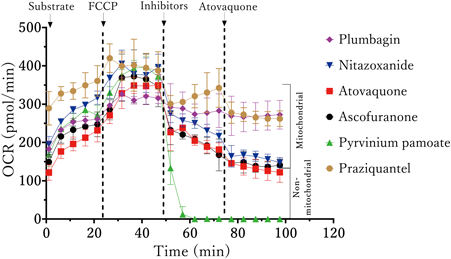
次に,フラックスアナライザー(XFe24, Agilent社)を用いて成虫の酸素消費速度(oxygen consumption rate:OCR)を測定し,ミトコンドリアの酸素呼吸阻害剤を評価した(図4)6).その結果,AFとATQは成虫のミトコンドリア由来OCRを阻害した.さらにPPはミトコンドリア由来と非ミトコンドリア由来の両方のOCRを阻害することがわかった(図4).また,結核菌で脱共役活性が報告されているnitazoxanideはOCRを阻害し,結核菌とマンソン住血吸虫では作用機序が異なることが明らかとなった(図4)25).
高濃度の硫化水素はミトコンドリアの酸素呼吸を阻害するため,高濃度硫化水素/亜硫酸環境適応の分子機構を明らかにすることは,マンソン住血吸虫成虫の寄生戦略を理解するために必要である.創薬研究の観点では,マンソン住血吸虫のミトコンドリア呼吸鎖はきわめて有望な感染予防薬剤の標的であることが明らかとなった.さらに,成虫においては呼吸鎖阻害剤による治療効果は限定的でありPZQほど薬効が期待できない.今後のマンソン住血吸虫症対策には治療と予防を同時に行う必要があり,住血吸虫症の撲滅にはミトコンドリア呼吸鎖特異的な阻害剤とPZQとの併用が最も効果的だと考えている6).
1)マラリア
マラリアはマラリア原虫感染によって引き起こされる原虫感染症であり,現在も年間60万人以上の死者と2憶人の感染者を生み出している26).マラリア原虫は媒介するハマダラカからヒト体内に侵入後,肝細胞に一度寄生して形態を変化させ,赤血球に感染する.マラリア原虫のこの段階は赤内期と呼ばれ,赤血球内で分裂増殖し新しい赤血球へ感染を繰り返すため,貧血や発熱といった症状を引き起こす.流行地域でのマラリア治療にはクロロキン,ピリメサミン,サルファドキシン,アルテミシニンなどの抗マラリア薬が使用される.WHOが推奨する第一選択療法であるアルテミシニン併用療法は非常に効果が高く,マラリア治療に多大な貢献を果たしてきたが,東南アジア・アフリカにおいてアルテミシニン耐性マラリア原虫が確認されている27, 28).グローバルヘルスの観点から流行地でのマラリア制圧,そして最終的に撲滅を目指すために,薬剤耐性マラリア原虫にも有効な新しい作用機序を持つ抗マラリア薬が求められている.
2)マラリア原虫ミトコンドリア
マラリア原虫は複合体Iを欠損しており,代わりにNADH:キノン酸化還元酵素の機能はII型NADH脱水素酵素(type II NADH dehydrogenase:NDH2)が担っている.NDH2に加えてコハク酸脱水素酵素(複合体II),リンゴ酸:キノン酸化還元酵素(malate:quinone oxidoreductase:MQO),DHODH, UQ-G3PDHがユビキノンを介して,複合体IIIに電子を伝達する.伝達された電子はCyt cを経由して複合体IVにより酸素に渡され,その過程で生じた電気化学的勾配を利用してATP合成酵素によってATPが合成される29).このように真核生物であるマラリア原虫にはヒト電子伝達系の機能がよく保存されているが,赤内期のATP合成は電子伝達系による酸化的リン酸化ではなく,解糖系による基質レベルのリン酸化に強く依存している.そのため赤内期においてはtricarboxylic acid(TCA)回路の多くの酵素やATP合成酵素のサブユニットが必須ではないことがわかっている30, 31).一方で,ミトコンドリアはエネルギー代謝以外にもさまざまな機能を担っている.その一つがピリミジンのde novo合成であり,ミトコンドリア内膜に局在するDHODHが合成経路の4番目の酵素として機能し,マラリア原虫赤内期の急速な分裂・増殖において重要な役割を果たしている32).生体内ではDNAやRNAの材料となるピリミジンはde novo合成経路とsalvage経路によって供給されるが,マラリア原虫はsalvage経路の酵素が欠損しており,de novo合成経路のみに依存している.そのためマラリア原虫赤内期ではDHODHは必須遺伝子であり,さらにヒトDHODH(HsDHODH)とマラリア原虫DHODH(PfDHODH)の基質結合部位の構造が異なるため,DHODHは抗マラリア薬の創薬標的の一つとなっている32, 33).
3)ミトコンドリアを標的とした創薬
このマラリア原虫のピリミジンのde novo合成経路に着目し,ミトコンドリアを標的とした抗マラリア薬開発が長年続けられている.米国で開発されたPfDHODH阻害剤であるDSM265はフェーズIIa臨床試験まで進んだが,耐性や毒性の問題により単剤での開発は残念ながら中止となった34, 35).またDHODHはユビキノン依存的に反応を触媒するため,還元されたユビキノンの再酸化を行う複合体IIIの阻害によっても類似した効果が期待できる(図5).マラリア原虫の複合体III阻害剤としては,ニューモシスチス肺炎とトキソプラズマ症の治療薬として開発されたアトバコンが知られ,ジヒドロ葉酸還元酵素阻害剤であるプログアニルとの合剤がマラロンとして製品化されている36).しかし,マラロンは高価であることに加えて,副作用の観点から妊婦や乳幼児への使用は限定的となっている.そのため旅行者の予防内服による使用が中心となっており,流行地でのマラリアのコントロールの使用には適していない.
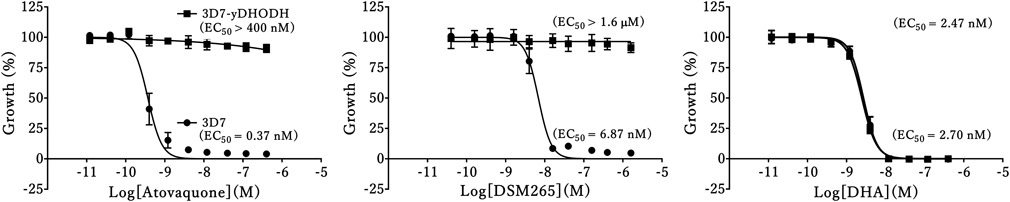
このようにマラリア原虫のミトコンドリアは魅力的な創薬標的であるが,画期的な新薬の開発には至っていない.そこで我々はミトコンドリアを標的とした創薬研究を進めている.2021年には京都大学の提供する化合物ライブラリー(40,400化合物)に対して組換えタンパク質を用いたスクリーニングを行い,新規骨格のDHODH阻害剤を報告した37).この研究では酵母DHODH(yDHODH)を発現する組換えマラリア原虫(3D7-yDHODH)38)を用いて,ヒット化合物の標的検証を行ったので内容を少し紹介したい.ヒトやマラリアのDHODHはミトコンドリア内膜に存在しユビキノンを電子受容体とするが,yDHODHは可溶性で細胞質に存在しフマル酸を電子受容体として用いる(図5).そのためyDHODHを発現する組換えマラリア原虫はミトコンドリア非依存的にオロト酸を生成することが可能となる(図5).3D7-yDHODHはDSM265やアトバコンに対して耐性になり,作用機序が異なるジヒドロアルテミシニン(dihydroartemisinin:DHA)に対しては感受性を示す(図6).この手法によりマラリア原虫のミトコンドリア特異的な阻害剤探索や,あるいは逆に異なる作用機序の阻害剤を選抜することが可能になる.我々のスクリーニングによって得られた新規骨格のDHODH阻害剤は現在,共結晶による複合体結晶構造解析を行っている.これらの結果を踏まえて,安全性が高く,また耐性の出にくいDHODH阻害剤の設計を行い,新しい抗マラリア薬開発につなげていきたいと考えている.
4. 寄生虫のエネルギー代謝酵素をツールとしたミトコンドリア病の解析
1)寄生原虫トリパノソーマのエネルギー代謝
アフリカ睡眠病はブルーストリパノソーマ(T. b. rhodesiense, T. b. gambiense)によって引き起こされ,住血吸虫症と同様にWHOによりNTDsの一つに認定されている寄生原虫感染症である.アフリカ睡眠病は吸血性昆虫ツェツェバエによって媒介され,ヒトの他ヤギやウシなどの哺乳類に感染する.感染初期は血流中で増殖し,慢性期には中枢神経系に障害を与えることで最終的に昏睡状態を引き起こし,治療しないと死に至ることがある39).
T. brucei spp.の形態は生活環によって変化し,昆虫内の形態はPCF,宿主哺乳類血液中での形態はBSFと呼ばれる.ミトコンドリアの形態と機能もまた生活環で大きく変わり,それに伴いエネルギー代謝様式も変化する.PCFではATP合成は哺乳類と同じ酸化的リン酸化によって行われている(図1C).一方,BSFではクリステ構造が消失し,解糖系酵素11種類中8種類を含むトリパノソーマ科原虫特異的な細胞小器官グリコソームにエネルギー代謝は依存する40).BSFではミトコンドリア呼吸鎖はATP合成に直接関与しないが,グリコソームで解糖系を常に進行させるためには解糖系で生じるNADHの再酸化が必須であり,これにミトコンドリア呼吸鎖の末端酸化酵素であるTAOが関わっている(図1D)9).
解糖系中間体のジヒドロキシアセトンリン酸(DHAP)はNAD+依存性グリセロール-3-リン酸(G3P)脱水素酵素(NAD-G3PDH)の逆反応により,グリコソーム内で生じるNADHを消費しDHAPをG3Pに還元する.次に,G3Pはミトコンドリア内膜に局在するUQ依存的なG3PDH(UQ-G3PDH)によって,G3Pの還元力をUQに伝達し,ユビキノール(UQH2)とDHAPを生成する(図1D).DHAPはグリコソームに移行しNAD-G3PDHの基質となり,UQH2の電子はTAOにより酸素の還元に使用される40).このプロセスはG3P/DHAPシャトルと呼ばれ,解糖系で生じる還元力を最終的に酸素に伝達するために必要である(図1D).TAOの機能は哺乳類の呼吸鎖複合体III–IV(UQH2オキシダーゼ)に相当するが,単一サブユニットで形成され,二核鉄を活性中心とし,プロトンポンプ機能を持たないことからATP合成とは共役していない9).
BSFでは,プロトンポンプ機能を持つ複合体IIIとIVは消失し,ミトコンドリア呼吸鎖はG3PDHとTAOのみで構成される.BSFのミトコンドリアはMitoTrackerで染められることから,膜電位は維持されていることがわかっている41, 42).そして,oligomycin A(複合体V阻害剤)処理で膜電位が消失することから,BSFの電気化学的勾配はATPを消費し複合体Vによる水素イオンの排出で維持されていることが明らかとなった42).しかし,このような機構で膜電位を保つためには大量のATPが必要であり,ミトコンドリア内ATPの供給源は不明であった.我々は,BSFのミトコンドリア内では酢酸:コハク酸CoA転移酵素(ASCT)とサクシニルCoA合成酵素(SCS)が共役してASCT/SCSサイクルを形成し,基質レベルのリン酸化でATPを合成していることを突き止めた10).そして,精製ASCTを用いた生化学的解析の結果,ASCT/SCSサイクルの分子活性(Kcat)は約200 ATP s−1であり,複合体VのKcatに匹敵するATP合成能を持つことを明らかにした10).T. b. bruceiの野生株はoligomycin A耐性だが,ASCTをノックアウトした原虫はoligomycin Aに対し,超感受性になることから,ASCT/SCSサイクルはトリパノソーマの増殖に必要なATP供給の機能を補っていることが明らかとなった43).このサイクルの最大の利点は酸化的リン酸化に依存せずにATPを合成できる点である10).
2)ヒトミトコンドリア病
哺乳類細胞では1細胞あたり数十~数百のミトコンドリアが存在し,1ミトコンドリアには5~10個のmtDNAが含まれているため,1細胞あたり数十~数千個のmtDNAが存在する44, 45).複製や修復の過程で点変異や欠損が生じた“変異型mtDNA”の割合が細胞内で一定数を超えるとミトコンドリア病と称される疾患が引き起こされる.たとえばMELAS(mitochondrial myopathy, encephalopathy, lactic acidosis and stroke-like episodes)はmtDNAの3243塩基,3271塩基,1,3513塩基などの変異を原因とし,脳卒中様症状や精神症状,筋力低下,糖尿病などの症状を引き起こす46, 47).またKSS(Kearns-Sayre syndrome)はmtDNAの単一大欠失によって引き起こされ,小脳失調や知能障害,難聴,網膜色素変性などの症状を引き起こす48, 49).このようにミトコンドリア病は非常に多様な症状を示す.
3)トリパノソーマエネルギー代謝酵素のヒトミトコンドリア病研究への応用
ヒトミトコンドリア病は,いまだに発症の分子機構が明らかにされていない希少疾患の一つである.症状は神経疾患や心筋症などさまざまであり,パーキンソン病やアルツハイマー病などもミトコンドリア病と関連するとされる50).これまでに,患者mtDNAに点変異や大規模な欠損がみられていることから,ミトコンドリア機能の低下が発症の一因であると考えられている45).ヒトmtDNAは呼吸鎖複合体I, III, IV, Vの複数のサブユニットをコードすることから,ミトコンドリア病では酸化的リン酸化の機能が破綻していることが推定される.しかし,酸化的リン酸化の「上流経路」,「下流経路」,「電気化学的勾配」と「ATP合成」の,どのステップの破綻がミトコンドリア病の発症に影響を与えるかを調べることは困難な課題であった.
そこで我々は,酸化的リン酸化に依存せずにエネルギー代謝を行うトリパノソーマ科原虫のTAOとASCTに着目した.それぞれを「キノール酸化」と「ATP合成」を単独で担う“パーツ”としてミトコンドリア異常細胞に発現させ「代替エネルギー代謝経路」を構築し部分的にレスキューすることで,ミトコンドリア病の発症メカニズムの解析に応用することができると考えた(図7).
TAOとASCTをそれぞれHeLa細胞(ヒト子宮頚がん由来)に強制発現させ,それぞれの酵素がヒト細胞で発現可能かつ,本来の機能を発現することが可能かどうかを検討した.フラックスアナライザーを用いてOCRの測定により,HeLa細胞に発現させたTAOとASCTの機能を評価した.ミトコンドリア異常細胞を模倣するために,TAO発現細胞に対しては各種阻害剤として,oligomycin A,カルボニルシアニド-p-トリフルオロメトキシフェニルヒドラゾン(FCCP;脱共役剤),antimycin A(複合体III阻害剤),ascofuranone(TAO阻害剤)を添加した.また,ASCT発現細胞に対してはoligomycin A, FCCP, antimycin Aを添加しOCRを測定した.その結果,コントロール細胞はantimycin Aまたはoligomycin A処理により死滅した.一方,TAOおよびASCT発現細胞は順にantimycin Aとoligomycin A耐性を示した.さらに,TAO発現細胞のOCRはantimycin Aではまったく阻害されず,ascofuranone添加で著しく阻害された.ASCT発現細胞は予想どおりoligomycin A耐性を示し,OCRに変化はみられなかった.さらに,oligomycin A処理条件下における細胞内全ATP量も正常細胞と同等量維持されることを確認した(Hayashishita M. et al., 未報告,論文作成中).
以上の結果からトリパノソーマ原虫由来のエネルギー代謝酵素であるTAOとASCTがヒト細胞内でも機能することが示された.今後は,ミトコンドリア病モデル細胞にTAOを発現させて「呼吸鎖下流経路」を補い,ASCTを発現させて「ATP合成」を単独で回復させることでミトコンドリア病発症機構に対し新しい知見が得られるものと期待される.
以上述べたように,寄生虫と宿主は両者ともに真核生物であり,特異性を担保できる標的が少ないために,ワクチンや創薬開発は困難である.一方,寄生虫のミトコンドリアは,構成酵素群や代謝経路が多様であり,各種寄生虫の生活環で寄生環境の適応と生存戦略においてきわめて重要な細胞小器官であり,創薬標的になりうる分子が比較的多く存在する.そして,寄生虫特異的なミトコンドリア酵素の生化学的特性の理解は,宿主のミトコンドリア異常がもたらす病態発症機構の解析にもつながる.今後,生命現象の一つである「寄生」のさらなる理解と抗寄生虫薬の創出のためには,寄生虫ミトコンドリアの存在意義とその多様性についてさらに理解を深める必要がある.
謝辞Acknowledgments
本稿で紹介したマンソン住血吸虫の各ステージに際し,長崎大学熱帯医学研究所寄生虫学分野の濱野真二郎教授と在籍した学生(Talaam Keith Kiplangat)の皆様にご助言とご協力いただきました.また,組換えマラリア原虫作製と化合物評価に際し,長崎大学熱帯医学研究所シオノギグローバル感染症連携部門細胞環境構築学分野の徳舛富由樹教授と分子感染ダイナミックス解析分野の吉田依里研究員と学生(Normalita Eka PravitasariとNgetich Japheth Kibet)の皆様にご協力いただきました.この場をお借りしてお礼申し上げます.
引用文献References
1) Hertweck, K.L. & Dasgupta, S. (2017) The landscape of mtDNA modifications in cancer: A tale of two cities. Front. Oncol., 7, 262.
2) 彦坂健児,田邉和行,北潔(2015)アピコンプレクサ門のミトコンドリアゲノム構造.原生動物学雑誌,48, 45–56.
3) Enkai, S., Inaoka, D.K., Kouguchi, H., Irie, T., Yagi, K., & Kita, K. (2020) Mitochondrial complex III in larval stage of Echinococcus multilocularis as a potential chemotherapeutic target and in vivo efficacy of atovaquone against primary hydatid cysts. Parasitol. Int., 75, 102004.
4) Kita, K. & Takamiya, S. (2002) Electron-transfer complexes in Ascaris mitochondria. Adv. Parasitol., 51, 95–131.
5) Matsumoto, J., Sakamoto, K., Shinjyo, N., Kido, Y., Yamamoto, N., Yagi, K., Miyoshi, H., Nonaka, N., Katakura, K., Kita, K., et al. (2008) Anaerobic NADH-fumarate reductase system is predominant in the respiratory chain of Echinococcus multilocularis, providing a novel target for the chemotherapy of alveolar echinococcosis. Antimicrob. Agents Chemother., 52, 164–170.
6) Talaam, K.K., Inaoka, D.K., Hatta, T., Tsubokawa, D., Tsuji, N., Wada, M., Saimoto, H., Kita, K., & Hamano, S. (2021) Mitochondria as a potential target for the development of prophylactic and therapeutic drugs against Schistosoma mansoni infection. Antimicrob. Agents Chemother., 65, e0041821.
7) Takashima, E., Takamiya, S., Takeo, S., Mi-ichi, F., Amino, H., & Kita, K. (2001) Isolation of mitochondria from Plasmodium falciparum showing dihydroorotate dependent respiration. Parasitol. Int., 50, 273–278.
8) Matsubayashi, M., Inaoka, D.K., Komatsuya, K., Hatta, T., Kawahara, F., Sakamoto, K., Hikosaka, K., Yamagishi, J., Sasai, K., Shiba, T., et al. (2019) Novel characteristics of mitochondrial electron transport chain from Eimeria tenella. Genes (Basel), 10, 29.
9) Shiba, T., Kido, Y., Sakamoto, K., Inaoka, D.K., Tsuge, C., Tatsumi, R., Takahashi, G., Balogun, E.O., Nara, T., Aoki, T., et al. (2013) Structure of the trypanosome cyanide-insensitive alternative oxidase. Proc. Natl. Acad. Sci. USA, 110, 4580–4585.
10) Mochizuki, K., Inaoka, D.K., Mazet, M., Shiba, T., Fukuda, K., Kurasawa, H., Millerioux, Y., Boshart, M., Balogun, E.O., Harada, S., et al. (2020) The ASCT/SCS cycle fuels mitochondrial ATP and acetate production in Trypanosoma brucei. Biochim. Biophys. Acta Bioenerg., 1861, 148283.
11) Miyazaki, Y., Inaoka, D.K., Shiba, T., Saimoto, H., Sakura, T., Amalia, E., Kido, Y., Sakai, C., Nakamura, M., Moore, A.L., et al. (2018) Selective Cytotoxicity of Dihydroorotate Dehydrogenase Inhibitors to Human Cancer Cells Under Hypoxia and Nutrient-Deprived Conditions. Front. Pharmacol., 9, 997.
12) Teschner, S. & Burst, V. (2010) Leflunomide: a drug with a potential beyond rheumatology. Immunotherapy, 2, 637–650.
13) Hards, K., Robson, J.R., Berney, M., Shaw, L., Bald, D., Koul, A., Andries, K., & Cook, G.M. (2015) Bactericidal mode of action of bedaquiline. J. Antimicrob. Chemother., 70, 2028–2037.
14) da Cruz, F.P., Martin, C., Buchholz, K., Lafuente-Monasterio, M.J., Rodrigues, T., Sönnichsen, B., Moreira, R., Gamo, F.J., Marti, M., Mota, M.M., et al. (2012) Drug screen targeted at Plasmodium liver stages identifies a potent multistage antimalarial drug. J. Infect. Dis., 205, 1278–1286.
15) Goodman, C.D., Siregar, J.E., Mollard, V., Vega-Rodriguez, J., Syafruddin, D., Matsuoka, H., Matsuzaki, M., Toyama, T., Sturm, A., Cozijnsen, A., et al. (2016) Parasites resistant to the antimalarial atovaquone fail to transmit by mosquitoes. Science, 352, 349–353.
16) Araki, Y., Awakawa, T., Matsuzaki, M., Cho, R., Matsuda, Y., Hoshino, S., Shinohara, Y., Yamamoto, M., Kido, Y., Inaoka, D.K., et al. (2019) Complete biosynthetic pathways of ascofuranone and ascochlorin in Acremonium egyptiacum. Proc. Natl. Acad. Sci. USA, 116, 8269–8274.
17) Shiba, T., Inaoka, D.K., Takahashi, G., Tsuge, C., Kido, Y., Young, L., Ueda, S., Balogun, E.O., Nara, T., Honma, T., et al. (2019) Insights into the ubiquinol/dioxygen binding and proton relay pathways of the alternative oxidase. Biochim. Biophys. Acta Bioenerg., 1860, 375–382.
18) WHO (2013) Schistosomiasis: progress report 2001–2011, strategic plan 2012–2020. World Health Organization, Geneva, Switzerland.
19) Aula, O.P., McManus, D.P., Jones, M.K., & Gordon, C.A. (2021) Schistosomiasis with a Focus on Africa. Trop Med Infect Dis, 6, 109.
20) Vale, N., Gouveia, M.J., Rinaldi, G., Brindley, P.J., Gärtner, F., & Correia da Costa, J.M. (2017) Praziquantel for Schistosomiasis: Single-Drug Metabolism Revisited, Mode of Action, and Resistance. Antimicrob. Agents Chemother., 61, e02582-16.
21) Van Hellemond, J.J., Van Remoortere, A., & Tielens, A.G. (1997) Schistosoma mansoni sporocysts contain rhodoquinone and produce succinate by fumarate reduction. Parasitology, 115, 177–182.
22) Berriman, M., Haas, B.J., LoVerde, P.T., Wilson, R.A., Dillon, G.P., Cerqueira, G.C., Mashiyama, S.T., Al-Lazikani, B., Andrade, L.F., Ashton, P.D., et al. (2009) The genome of the blood fluke Schistosoma mansoni. Nature, 460, 352–358.
23) de Mori, R.M., Aleixo, M.A.A., Zapata, L.C.C., Calil, F.A., Emery, F.S., & Nonato, M.C. (2021) Structural basis for the function and inhibition of dihydroorotate dehydrogenase from Schistosoma mansoni. FEBS J., 288, 930–944.
24) Calixto, N.M., Dos Santos, D.B., Bezerra, J.C.B., & Silva, L.A. (2018) In silico repositioning of approved drugs against Schistosoma mansoni energy metabolism targets. PLoS One, 13, e0203340.
25) de Carvalho, L.P., Darby, C.M., Rhee, K.Y., & Nathan, C. (2011) Nitazoxanide Disrupts Membrane Potential and Intrabacterial pH Homeostasis of Mycobacterium tuberculosis. ACS Med. Chem. Lett., 2, 849–854.
26) WHO (2021) WHO World Malaria Report 2021.
27) Balikagala, B., Fukuda, N., Ikeda, M., Katuro, O.T., Tachibana, S.I., Yamauchi, M., Opio, W., Emoto, S., Anywar, D.A., Kimura, E., et al. (2021) Evidence of Artemisinin-Resistant Malaria in Africa. N. Engl. J. Med., 385, 1163–1171.
28) Ariey, F., Witkowski, B., Amaratunga, C., Beghain, J., Langlois, A.C., Khim, N., Kim, S., Duru, V., Bouchier, C., Ma, L., et al. (2014) A molecular marker of artemisinin-resistant Plasmodium falciparum malaria. Nature, 505, 50–55.
29) Mogi, T. & Kita, K. (2010) Diversity in mitochondrial metabolic pathways in parasitic protists Plasmodium and Cryptosporidium. Parasitol. Int., 59, 305–312.
30) Ke, H., Lewis, I.A., Morrisey, J.M., McLean, K.J., Ganesan, S.M., Painter, H.J., Mather, M.W., Jacobs-Lorena, M., Llinás, M., & Vaidya, A.B. (2015) Genetic investigation of tricarboxylic acid metabolism during the Plasmodium falciparum life cycle. Cell Rep., 11, 164–174.
31) Sturm, A., Mollard, V., Cozijnsen, A., Goodman, C.D., & McFadden, G.I. (2015) Mitochondrial ATP synthase is dispensable in blood-stage Plasmodium berghei rodent malaria but essential in the mosquito phase. Proc. Natl. Acad. Sci. USA, 112, 10216–10223.
32) Phillips, M.A. & Rathod, P.K. (2010) Plasmodium dihydroorotate dehydrogenase: a promising target for novel anti-malarial chemotherapy. Infect. Disord. Drug Targets, 10, 226–239.
33) Zhang, M., Wang, C., Otto, T.D., Oberstaller, J., Liao, X., Adapa, S.R., Udenze, K., Bronner, I.F., Casandra, D., Mayho, M., et al. (2018) News at a glance. Science, 360, 360–361.
34) Phillips, M.A., Lotharius, J., Marsh, K., White, J., Dayan, A., White, K.L., Njoroge, J.W., El Mazouni, F., Lao, Y., Kokkonda, S., et al. (2015) A long-duration dihydroorotate dehydrogenase inhibitor (DSM265) for prevention and treatment of malaria. Sci. Transl. Med., 7, 296ra111.
35) Llanos-Cuentas, A., Casapia, M., Chuquiyauri, R., Hinojosa, J.C., Kerr, N., Rosario, M., Toovey, S., Arch, R.H., Phillips, M.A., Rozenberg, F.D., et al. (2018) Antimalarial activity of single-dose DSM265, a novel plasmodium dihydroorotate dehydrogenase inhibitor, in patients with uncomplicated Plasmodium falciparum or Plasmodium vivax malaria infection: a proof-of-concept, open-label, phase 2a study. Lancet Infect. Dis., 18, 874–883.
36) Kovacs, J.A. (1992) Efficacy of atovaquone in treatment of toxoplasmosis in patients with AIDS. Lancet, 340, 637–638.
37) Hartuti, E.D., Sakura, T., Tagod, M.S.O., Yoshida, E., Wang, X., Mochizuki, K., Acharjee, R., Matsuo, Y., Tokumasu, F., Mori, M., et al. (2021) Identification of 3,4-Dihydro-2H,6H-pyrimido[1,2-c][1,3]benzothiazin-6-imine Derivatives as Novel Selective Inhibitors of Plasmodium falciparum Dihydroorotate Dehydrogenase. Int. J. Mol. Sci., 22, 7236.
38) Painter, H.J., Morrisey, J.M., Mather, M.W., & Vaidya, A.B. (2007) Specific role of mitochondrial electron transport in blood-stage Plasmodium falciparum. Nature, 446, 88–91.
39) Baker, C.H. & Welburn, S.C. (2018) The Long Wait for a New Drug for Human African Trypanosomiasis. Trends Parasitol., 34, 818–827.
40) Nihei, C., Fukai, Y., & Kita, K. (2002) Trypanosome alternative oxidase as a target of chemotherapy. Biochim. Biophys. Acta, 1587, 234–239.
41) Brown, S.V., Hosking, P., Li, J., & Williams, N. (2006) ATP synthase is responsible for maintaining mitochondrial membrane potential in bloodstream form Trypanosoma brucei. Eukaryot. Cell, 5, 45–53.
42) Schnaufer, A., Clark-Walker, G.D., Steinberg, A.G., & Stuart, K. (2005) The F1-ATP synthase complex in bloodstream stage trypanosomes has an unusual and essential function. EMBO J., 24, 4029–4040.
43) Millerioux, Y., Morand, P., Biran, M., Mazet, M., Moreau, P., Wargnies, M., Ebikeme, C., Deramchia, K., Gales, L., Portais, J.C., et al. (2012) ATP synthesis-coupled and -uncoupled acetate production from acetyl-CoA by mitochondrial acetate:succinate CoA-transferase and acetyl-CoA thioesterase in Trypanosoma. J. Biol. Chem., 287, 17186–17197.
44) Yu-ichi, G. (2016). Equilib. Res., 75.
45) Chinnery, P.F. (2000) Primary mitochondrial disorders overview. in GeneReviews (Adam, M.P., Ardinger, H.H., Pagon, R.A., Wallace, S.E., Bean, L.J.H., Gripp, K.W., Mirzaa, G.M., & Amemiya, A., eds.), University of Washington, Seattle.
46) Ikeda, T., Osaka, H., Shimbo, H., Tajika, M., Yamazaki, M., Ueda, A., Murayama, K., & Yamagata, T. (2018) Mitochondrial DNA 3243A>T mutation in a patient with MELAS syndrome. Hum. Genome Var., 5, 25.
47) Pia, S. & Lui, F. (2022) Melas syndrome. in StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan.2021 Sep 25.
48) Comte, C., Tonin, Y., Heckel-Mager, A.M., Boucheham, A., Smirnov, A., Auré, K., Lombès, A., Martin, R.P., Entelis, N., & Tarassov, I. (2013) Mitochondrial targeting of recombinant RNAs modulates the level of a heteroplasmic mutation in human mitochondrial DNA associated with Kearns Sayre Syndrome. Nucleic Acids Res., 41, 418–433.
49) Goldstein, A. & Falk, M.J. (2003) Mitochondrial DNA deletion syndromes. in GeneReviews (Adam, M.P., Ardinger, H.H., Pagon, R.A., Wallace, S.E., Bean, L.J.H., Gripp, K.W., Mirzaa, G.M., & Amemiya, A., eds.), University of Washington, Seattle.
50) Yan, M.H., Wang, X., & Zhu, X. (2013) Mitochondrial defects and oxidative stress in Alzheimer disease and Parkinson disease. Free Radic. Biol. Med., 62, 90–101.
著者紹介Author Profile
 稲岡 健ダニエル(いなおか けんだにえる)
稲岡 健ダニエル(いなおか けんだにえる)長崎大学熱帯医学研究所シオノギグローバル感染症連携部門分子感染ダイナミックス解析分野准教授.博士(薬学).
略歴1978年サンパウロ州に生る.2000年リオグランデドノルテ州立大学薬学部卒業.05年東京大学薬学部博士課程修了.05–16年東京大学大学院医学系研究科ポスドク・助教.16年長崎大学TMGH助教.19年より現職.
研究テーマと抱負病原体(寄生虫,細菌)やがんの微小環境適応におけるエネルギー代謝の役割を明らかにし,創薬や研究ツール開発に繋げたい.
ウェブサイトhttp://www.tm.nagasaki-u.ac.jp/molecdyna/
趣味釣り,素潜り,映画鑑賞.
 林下 瑞希(はやしした みずき)
林下 瑞希(はやしした みずき)長崎大学大学院熱帯医学・グローバルヘルス研究科ポスドク.博士(理学).
略歴1989年東京都に生る.2012年首都大学東京(現・東京都立大学)都市教養学部都市教養学科理工学系生命科学コース卒業.14年同大学院博士前期課程修了.19年同大学院博士後期課程修了.同年より現職.
研究テーマと抱負研究テーマは,様々な環境下におけるミトコンドリアのエネルギー代謝と品質管理機構の解明.多様な生物の生命現象を多角度から見ることで,基礎研究の発展に貢献したい.
趣味釣り,散歩.
 北 潔(きた きよし)
北 潔(きた きよし)長崎大学大学院熱帯医学・グローバルヘルス研究科研究科長.薬学博士.
略歴1951年東京に生る.1974年東京大学薬学部卒業.80年同大学院薬学系研究科博士課程修了.80~90年東京大学理学部,順天堂大学医学部で助手・講師.91–2016年東京大学医科学研究所・大学院医学系研究科で助教授・教授.15年より現職.
研究テーマと抱負研究としては代謝調節,とくにエネルギー代謝における「低酸素適応の分子機構」の研究から得られる情報をもとに感染症を中心とする新規薬剤の開発を試みている.
ウェブサイトhttps://www.tmgh.nagasaki-u.ac.jp/about_tmgh/dean
http://www.tm.nagasaki-u.ac.jp/nekken/departments/biochemistry.html
趣味旅行,マニュアル車の運転.
 佐倉 孝哉(さくら たかや)
佐倉 孝哉(さくら たかや)長崎大学熱帯医学研究所シオノギグローバル感染症連携部門分子感染ダイナミックス解析分野助教.博士(医学).
略歴1984年大阪府に生る.2007年神戸大学医学部保健学科卒業.09年同大学院保健学研究科修士課程修了.13年長崎大学大学院医歯薬学総合研究科博士課程修了.13~19年国立感染症研究所,パスツール研究所などでポスドク.19年より現職.
研究テーマと抱負分子生物学・細胞生物学・オミクス解析を用いて寄生原虫の感染メカニズムを解明することを主な研究テーマとしている.寄生虫やがん細胞が持つ特異な細胞内エネルギー代謝に着目した創薬を展開したい.
ウェブサイトhttp://www.tm.nagasaki-u.ac.jp/molecdyna/
趣味子供の世話,旅行.