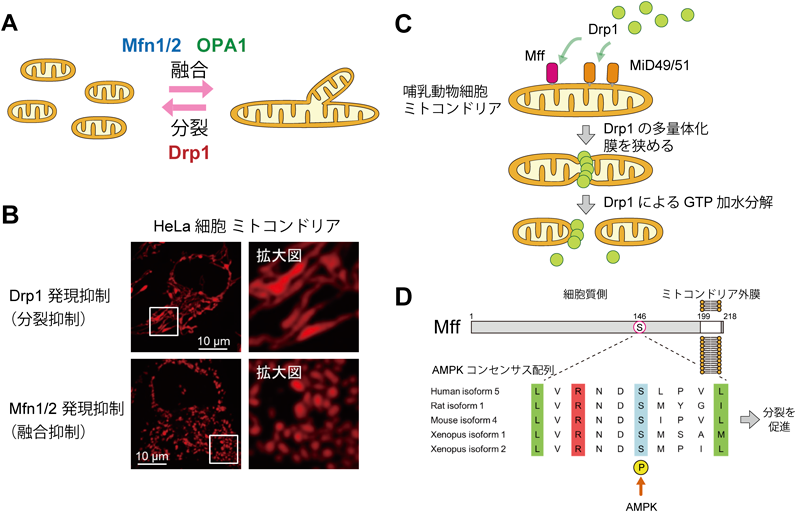
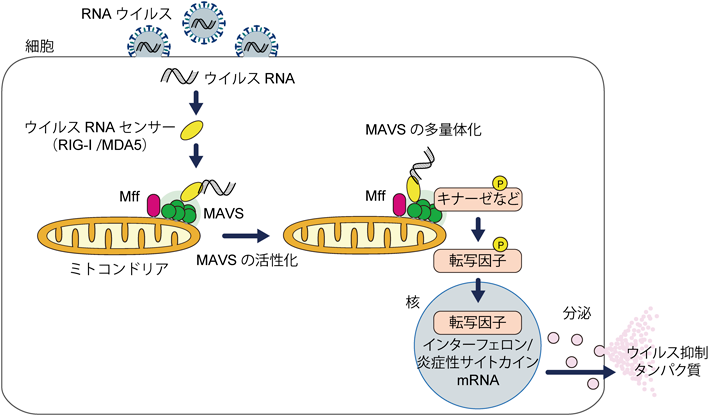
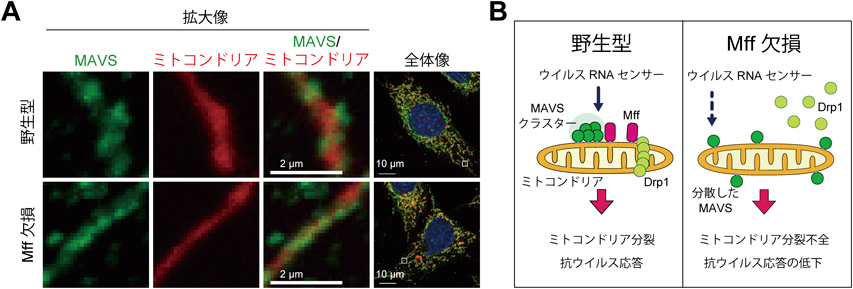
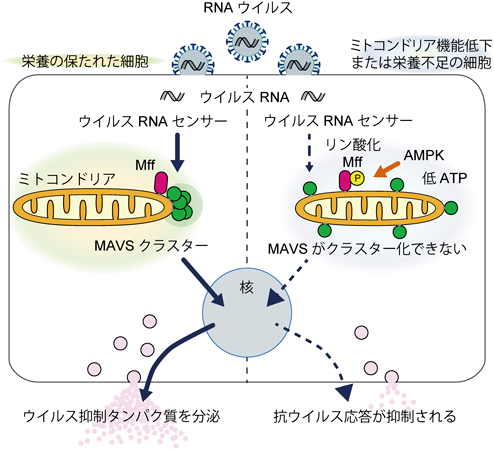
代謝と自然免疫をつなぐミトコンドリアの細胞情報伝達機構Molecular mechanism linking metabolism and innate immunity on mitochondria
大阪大学大学院理学研究科生物科学専攻Department of Biological Sciences, Graduate School of Science, Osaka University ◇ 〒560–0043 大阪府豊中市待兼山町1–1 ◇ 1–1 Machikaneyama, Toyonaka, Osaka 560–0043, Japan