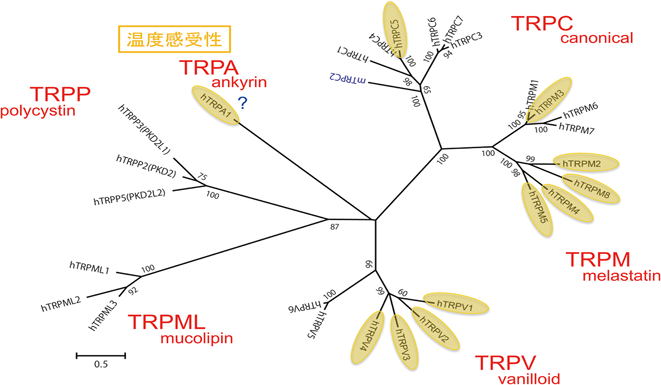
1)カプサイシン受容体TRPV1
トウガラシの主成分であるカプサイシンは辛みとともに痛みを惹起する.発現クローニング法を用いて単離されたカプサイシン受容体は,当初vanilloid receptor subtype 1(VR1)と命名されたが,現在ではTRPV1と呼ばれている1, 12).特異的抗体を用いた解析から後根神経節細胞,三叉神経節細胞および自律神経求心線維に加え,一次求心性線維が投射される脊髄後角の表層(第I, II層)と尾側三叉神経核へのTRPV1タンパクの発現が示されたが,その後,中枢神経系での発現も報告されている13).TRPV1発現細胞を用いた電気生理学的解析に加え,TRPV1欠損マウス個体レベルでの検討でもTRPV1が複数の侵害刺激の受容体として機能することが確認されている.TRPV1欠損マウスの最も顕著な表現型は炎症性の熱性痛覚過敏の減弱であり,TRPV1が炎症性疼痛の発生に強く関わっていることと合致する14, 15).
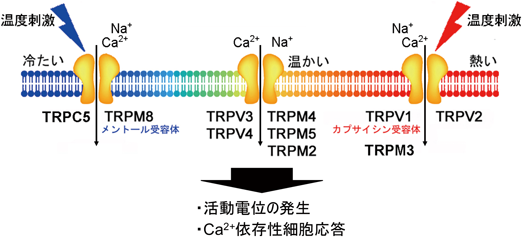
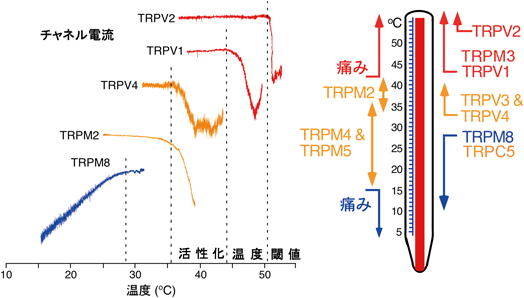
TRPV1は高いCa2+透過性を有する非選択性陽イオンチャネルであり,カプサイシンと同様に生体に痛みを惹起する酸(プロトン)によっても活性化する.このTRPV1の性質はカプサイシン感受性の侵害受容神経が複数の刺激に応答する(ポリモーダル侵害受容器)ことと合致する.トウガラシを食べると口の中がカッカする.培養細胞にラットのTRPV1を強制発現させて熱刺激を加えると,TRPV1活性化による細胞内Ca2+濃度上昇や膜電流が観察され,その活性化温度閾値は約43°Cであった(図3).この43°Cという温度はヒトを含めた霊長類が痛みを感じ始める温度と非常によく一致しており,TRPV1は侵害性熱刺激受容体と考えられている.ちなみに「辛み」は「痛み」に似た感覚であり,味覚とは異なる.
カプサイシンは生体内には存在しないことから,内因性リガンドの存在が推定されてきた.内因性カンナビノイドのアナンダミドやリポシキゲナーゼ産物等が内因性リガンドとして報告されている16–19).それらの多くは直接TRPV1を活性化するとともに,他刺激によるTRPV1の活性化電流を増大させる.リポシキゲナーゼ産物はブラジキニンやヒスタミン等の代謝型受容体活性化の下流でアラキドン酸を基質として産生されるため,炎症性疼痛の発生経路の一つとして働くと考えられる.炎症部位において産生増加する活性酸素および一酸化窒素(NO)もTRPV1を活性化する.
さらに,TRPV1はリン酸化等のタンパク質修飾によって機能が増強することが知られ,熱による活性化温度閾値が変化する20).組織炎症により産生・放出される炎症関連メディエーター(ATP,プロテアーゼ,ブラジキニン,プロスタグランジンなど)は,それらの代謝型受容体に作用してタンパク質リン酸化酵素(PKCやPKA)を活性化しTRPV1をリン酸化する.その結果,TRPV1の活性化温度閾値が大幅に低下して体温による活性化が可能となり,恒常的な活性化により急性炎症性疼痛を生じると考えられる.より弱い熱刺激によって痛みを感じる現象は「熱性痛覚過敏」とも呼ばれ,夏に日焼けして炎症が起こり,本来痛みを引き起こさないような低温で痛みを感じる経験を説明する.TRPV1は我々に痛みをもたらす複数の刺激(カプサイシン,熱や酸など)で活性化するが,それらの刺激は相乗効果を示すことが知られており,直接TRPV1を活性化しない少量のカプサイシン刺激が存在すればより低い温度でTRPV1は活性化する.熱々のカレーを食べるとより辛く感じるわけで,辛みを減じる最も効果的な方法が温度を下げる(冷水を飲む)ことなのも理解しやすい.
PKCを介したTRPV1の感作は糖尿病性神経症にも関与し,低酸素,高グルコース条件下の培養によりラット後根神経節細胞のカプサイシン活性化電流が有意に増大する21).TRPV1の異所性発現系では,低酸素,高グルコースによる電流の増大はないものの脱感作(活性化刺激への感受性が低下する現象)が有意に減弱した.低酸素,高グルコースの効果がTRPV1のPKCεによるリン酸化の作用部位の変異体では観察されなかったことから,TRPV1のリン酸化を介すると考えられた.低酸素によりPKCεの細胞膜移行が観察されることから,PKCε活性がTRPV1感作の原因と考えられる.
TRPV1の活性化が痛み感覚をもたらすことは明らかであり,TRPV1を作用標的とした創薬は遺伝子クローニング以後世界中で行われてきた.細胞レベルでの解析からTRPV1は急性痛,とりわけ急性炎症性疼痛に関与すると考えられ,TRPV1阻害物質が鎮痛薬として機能するものと期待された.多くの構造の異なる選択的TRPV1阻害剤の効果が検討されてきており,BCTC, AMG9810, A425619, SB-705498等によるCFA(complete Freund’s adjuvant)による炎症性疼痛モデルでの鎮痛効果が報告されている22–24).それらの化合物は,熱性あるいは機械刺激痛覚過敏のみならず機械刺激異痛症(allodynia)も軽減し,神経障害性疼痛モデルや術後痛,がん性疼痛,骨関節炎モデルにも効果を示す.これまでに数多くのTRPV1阻害薬について鎮痛剤としての使用を目指した臨床試験が行われてきたが25, 26),著しい効果をあげているものは少ないようである.また,体温上昇(発熱)や温度感覚異常(熱いものを熱いと感じない)が副作用として報告されている.TRPV1欠損マウスはTRPV1阻害剤による体温上昇を示さないことから,阻害剤による急激なTRPV1の機能阻害が体温上昇をもたらしていると考えられる.
2)TRPV2
TRPV2は52°C以上の温度で活性化されるチャネルとして報告され(図3),後に機械刺激感受性が明らかになった27, 28).他の多くのTRPチャネルと同様,高いCa2+透過性を有する.TRPV2の細胞膜への発現量は,さまざまな経路により調節されることが報告されている.TRPV2のN-グリコシル化はTRPV2の膜局在を上昇させる29).また,インスリン様成長因子(IGF-1)はPI3キナーゼの経路を介して細胞内小胞輸送を促進し,TRPV2の膜発現を増加させる30).この現象は膵臓β細胞株などの培養細胞でもみられるが,一方でPI3キナーゼはTRPV2タンパク質のトランスロケーションとは関係のないメカニズムでTRPV2を活性化するという報告もある31).
TRPV2は,感覚神経および中枢神経細胞,免疫細胞,脂肪細胞,上皮細胞,心筋・血管平滑筋細胞,膵臓β細胞などに発現している27, 32).感覚神経に発現するTRPV2は,当初,環境温度を感知する機能を持っている可能性が示唆されていたが27),TRPV2欠損マウスの解析から,現在では環境温度受容に関与している可能性は低いと考えられている33).成熟マウスではTRPV2を発現する感覚神経細胞の数は少ないが,マウス胎生10.5日ではほとんどの感覚神経に発現しており,TRPV2は発達過程での神経軸索の伸展に関与している34).軸索伸張に伴う膜への伸展刺激によってTRPV2が活性化され,さらなる軸索伸張を促すと考えられる.
消化管でもTRPV2は,特に腸管内(腸筋層間神経叢)に存在する抑制性運動神経に発現しており,NO産生酵素(NOS)との共発現が観察された35).腸管抑制性運動神経のTRPV2は機械刺激によって活性化した.TRPV2活性化剤(プロベネシド)処置によりマウス腸管からのNO放出が促進するとともに,小腸の収縮力がNO依存的に減弱した.TRPV2活性化剤によってマウス腸管内の物質移動は著しく促進されたことから,抑制性運動神経のTRPV2が食塊による腸管壁伸展を感知し,Ca2+流入とNO産生をもたらすことで肛門側の腸管弛緩を導いているものと考えられた35).このことは,消化管内の食塊移動をスムーズに行うメカニズムの一つかもしれない.
膵臓ではTRPV2は主にインスリン分泌細胞であるβ細胞に発現し,IGF-1のシグナルを介してインスリン分泌に関与することが報告されている30).心筋においては,IGF-1の分泌に関係しており,TRPV2を心筋細胞特異的に欠損したマウスでは,心肥大がみられる36).いずれの生理機能も,TRPV2活性化に伴う細胞内Ca2+濃度上昇が重要な役割を果たしていると考えられている.
加えて我々は,褐色脂肪細胞においてTRPV2が非ふるえ熱産生に関与していることを明らかにした37).TRPV2欠損マウスは,褐色脂肪組織において寒冷曝露によって引き起こされる交感神経活動依存的な熱産生能の低下,ならびにUCP1などの熱産生関連遺伝子発現上昇の低下がみられた.また,褐色脂肪細胞特異的に発現するβ3受容体アゴニストならびにアデニル酸シクラーゼを活性化した際に起こる熱産生がTRPV2欠損細胞において減弱しており,熱産生関連遺伝子発現量上昇も低下していた.したがってTRPV2は少なくともGs共役型受容体であるβ3受容体のアデニル酸シクラーゼの下流で機能していると考えられる.膜透過性Ca2+キレーター(BAPTA-AM)によって脂肪細胞における熱産生関連遺伝子の発現上昇が抑制されることから,TRPV2活性を介した細胞内Ca2+シグナルが褐色脂肪細胞における熱産生に関わっていることが示唆される.さらに,マウス褐色脂肪細胞の分化初期において,TRPV2活性はカルシニューリン経路を介して,むしろ分化を抑制することも明らかになった38).
3)TRPV3
TRPV3はTRPV1との配列類似性から見いだされた,表皮や口腔上皮のケラチノサイトおよび毛胞ケラチノサイトに発現するTRPチャネルである39, 40).温かい温度(33~35°C),樟脳(カンファー)や,ハーブの成分であるカルバクロール,チモールなどの天然化合物が有効刺激として知られる.初めて温度刺激に暴露されるTRPV3の活性化温度閾値は温かい温度域ではなく約50°C以上であり,繰り返しの熱刺激が温度閾値を低下させるとの報告もある41).
TRPV3は温かい温度で活性化することと,温感を惹起する上記天然化合物によって活性化することから,体性感覚における温受容体の分子実体ではないかと考えられた.TRPV3欠損マウスを用いた行動解析においては,肯定的な結果と否定的な結果が報告されている42, 43).TRPV3は皮膚ケラチノサイトに存在するため,ケラチノサイトがどのように一次感覚神経に温度情報を伝達するのか,そのメカニズムについて多くの研究がなされ,ケラチノサイトからのATP放出44, 45),PGE2産生の亢進46),NO産生の亢進47)が候補としてあげられており,我々はATPが伝達物質となっているモデルを提唱している.細胞内でエネルギー源として使われるATPが神経伝達物質として働くことは広く認知されており,グリア細胞から神経細胞,味細胞から味神経など,幅広い情報伝達に関わっている.
TRPV3は,表皮および毛胞ケラチノサイト機能との関連が多く報告されている.TRPV3欠損マウスは出生直後から体毛が縮れており,毛根がばらばらな向きを向いているといった体毛の異常が認められる48).この表現型はケラチノサイトの増殖・分化に重要な役割を果たすTGF-αやその受容体であるEGFR系を抑制したマウスにおいても認められる.TRPV3はケラチノサイト増殖・分化,特に毛胞ケラチノサイトを最終分化に導く正のフィードバックを担うTGF-α/EGFR系において細胞外Ca2+流入路として機能していることが示唆された48).TRPV3のgain-of-functionを原因とするヒトの遺伝性疾患Olmsted症候群が知られ,手足および開口部周辺の角質増殖,脱毛,激しい痒み・痛みを症状とする.このうち脱毛は,ヒトにみられるアミノ酸変異と同様の変異を持つマウス(Ds-Nhマウス,G573S)およびラット(WBN-Kob-Ht, G573C)でもみられ49),変異による定常的なTRPV3活性化により,毛胞ケラチノサイトの細胞死により発毛が妨げられると考えられる50).
同様に,Olmsted症候群における角質増殖(角皮症)は,表皮ケラチノサイトにおけるTRPV3過剰活性化によりTGF-α/EGFR系が亢進し,表皮・基底層の細胞が異常増殖した結果であると推測される.反対にTRPV3欠損マウスではTGF-α/EGFRが抑制されることによって基底層の細胞の増殖が抑制された結果,早期分化が亢進し中間層が相対的に厚くなる48).創傷治癒においてもケラチノサイトの増殖・分化が重要であり,TRPV3欠損マウスでは治癒が遅延する47, 51).特に,口腔内上皮細胞はTRPV4(後述)よりTRPV3が強く発現しており,温度依存的にTGF-α/EGFR系を介した細胞増殖が強く進むこと,それがTRPV3欠損マウスでは大きく障害されることを我々は報告した51).口腔内の傷が治りやすいメカニズムの一つかもしれない.
4)TRPV4
TRPV4は線虫のポリモーダル受容体Osm-9やTRPV1, TRPV2との配列類似性から同定された低浸透圧,温かい温度(34°C)および内在性カンナビノイドであるアナンダミドによって活性化される非選択性陽イオンチャネルである(図3)52–54).TRPV4は血管内皮55),軟骨56),腎・遠位曲尿細管53),脳・脈絡叢上皮52),膀胱上皮57)および表皮58)などに分布し,感覚神経を含めた一部の神経細胞における発現も報告されている59, 60).
TRPV3同様,TRPV4も温かい温度で活性化することから体性感覚における温かい温度を感受する温受容体の分子実体ではないかと考えられた.実際にTRPV4欠損マウスが野生型マウスと比べてより温かい環境を好むことが示され61),侵害性の熱応答や機械刺激応答,もしくは温度刺激に伴う痛覚過敏への関与も示唆されたが62),侵害性・非侵害性応答とも変化がないという報告もある43).
さらに,TRPV4は数%といった非常に小さな浸透圧変化によって活性化することから,生体内における浸透圧受容体の分子実体であることが示唆されている52).低浸透圧によるTRPV4活性化においては,TRPV4が細胞膜の伸展を直接認識するのではなく,低浸透圧刺激によって細胞膜から遊離するアラキドン酸が代謝されることで産生される5′,6′-エポキシエイコサトリエン酸(5′,6′-EET)もしくは8′,9′-EETがTRPV4を活性化すると考えられている55, 63).TRPV4欠損マウスは,定常状態および脱水時の血漿浸透圧の増加,脱水によるバソプレシン分泌の低下を呈し,TRPV4が全身の浸透圧状態の変化を感知する受容体となっていることが示唆された59).
また,TRPV4はAQP4(水チャネル)やANO1(Cl−チャネル)と共役することによって細胞容積や水分泌の調節に関与し64–66)(後述),TRPP2と相互作用して腎・上皮細胞の繊毛における圧受容に関与している67).眼内圧の調節を行う小柱網(trabecular meshwork)内の細胞の一次繊毛の形成に重要な役割を果たしており,実際TRPV4欠損マウスにおいて眼内圧が低下していることが報告された68).膀胱においてTRPV4は上皮細胞の中間層および基底層に存在し,膀胱の内圧の増加を感知して細胞内Ca2+増加を介して細胞外にATPを放出し,その情報を一次感覚神経に伝えていると考えられる57, 69).実際にTRPV4欠損マウスにおいて排尿行動の異常と,膀胱の伸展時に認められる細胞外ATP濃度上昇の低下が観察され57),情報を受け取る側の感覚神経のATP受容体欠損マウスでは膀胱機能異常が起こる70, 71).
TRPV4はまた,圧受容を担う受容体としてのみならず細胞の分化にも重要な役割を果たすことがわかってきた.たとえば,表皮ケラチノサイトの分化においてTRPV4は細胞間結合の形成に関与し,上皮バリア機能の形成・維持に貢献している.TRPV4を通って流入したCa2+がRho依存的にアドヘレンスジャンクションの機能増強からタイトジャンクション制御を行っているものと考えられた58).TRPV4欠損マウスの皮膚は角化層が厚く,タイトジャンクション機能が低下していて,角化層を除去すると水分蒸散が増強する.皮膚のバリア機能は温度の影響を大きく受けることが知られ,冷たい温度ではバリア機能が働きにくい.したがって,TRPV4が皮膚温(通常33~34°C)で活性化して皮膚のバリア機能を強めて皮膚からの水分蒸散を防いでいるのではないかと考えられる58).このメカニズムはヒトケラチノサイトでも確かめられており,冬期に皮膚が乾燥するのはTRPV4が活性化しにくくなってバリア機能が弱くなって水分蒸散が大きくなることも原因かもしれない72).
TRPV4と細胞分化の関係について最も研究が進んでいるものの一つは軟骨細胞である56).TRPV4は軟骨細胞に非常に多く発現し,おそらく外からの機械刺激に応答し細胞内Ca2+濃度上昇およびカルモジュリン活性化により転写因子SOX9を介して軟骨細胞の分化を促す.実際にTRPV4遺伝子の変異に起因するヒトでの遺伝病が多く報告されているが73),症状として骨形成の異常を呈するものと,末梢神経障害を示すものがある.いずれもTRPV4のN末端に位置するアンキリンリピートドメインへの変異が認められるが,立体構造解析により骨形成異常と末梢神経障害の変異がドメインの異なる面に局在していることが明らかとなった74).
我々は,神経機能の調節に重要な役割を果たすグリア細胞(ミクログリアおよびシュワン細胞)においてもその機能調節にTRPV4が関わることを報告した.ミクログリアは,脳内に存在する免疫担当細胞であり,ダメージを受けた細胞等の貪食・除去を行うことで脳内の恒常性維持に働く.ミクログリアは高い運動性を有し,そのダイナミックな動きにより周囲環境に生じた異常を監視する働きをする.マウス脳より単離したミクログリアを用いた検討の結果,温度の上昇に伴ってその移動距離が有意に増加した75).温度依存性の運動性上昇はTRPV4欠損マウス細胞において消失するとともに,野生型細胞へのTRPV4活性化剤GSK1016790A処置によっても運動性の上昇が認められた.さらに,ミクログリアを蛍光標識したマウスを用いた生体での二光子顕微鏡観察により,生きたマウス脳内におけるミクログリアの突起の運動性を測定したところ,温度依存性に突起の運動性が上昇し,その運動性上昇がTRPV4欠損マウスで減弱していた.これらの結果より,マウス脳内ミクログリアがTRPV4により脳内の温度依存的に運動性を増加させ,神経の機能を監視・調節していると考えられる.脳のダメージで脳内温度が上昇するとミクログリアが活発になることで,ダメージからの回復を早める可能性が示唆される.一方,シュワン細胞は,末梢神経に髄鞘を形成することで絶縁性を高め,神経伝達を効率化する役割を持つ.神経障害等により髄鞘が破壊された状態を脱髄といい,神経伝達の異常により運動障害などを引き起こす.脱髄に伴ってシュワン細胞が再び髄鞘を形成する再髄鞘化は,神経障害からの回復において重要なプロセスとなる.我々は,坐骨神経障害モデルにおいて神経障害に続いて非ミエリンシュワン細胞におけるTRPV4の発現量が増加し,髄鞘関連タンパク質の発現調節を介して再髄鞘化を早める働きをすることを見いだした76).さらに坐骨神経切断後の髄鞘および坐骨神経機能の回復が,野生型に比較してTRPV4欠損マウスでは有意に遅延しており,非ミエリンシュワン細胞におけるTRPV4活性が再髄鞘化を促進していることが示唆された.
5)TRPM2
TRPM2は,温度に加えて(図3)内因性リガンドであるアデノシン二リン酸リボース(ADPR)や環状アデノシン二リン酸リボース(cADPR),細胞内Ca2+とともに活性酸素(レドックスシグナル,後述)による活性化を受けることから,Ca2+過負荷による細胞死との関連が報告されてきた77, 78).ADPRはTRPM2のC末端側にあるNUDT9 ADPRピロホスファターゼ(ADPRをアデノシン一リン酸とリボース5-リン酸に分解する)に似た構造のNudixドメインに結合し,TRPM2の活性化をもたらすと考えられてきたが77),低温電子顕微鏡法を用いた構造解析の報告により,このドメインに加えてN末端にもADPR結合部位が存在することが示された79).ADPRによるTRPM2活性化を競合的に阻害する8-Br-cADPRはN末端にのみ結合していたことから,ADPRによるTRPM2活性化にはN末端へのADPR結合が重要であると考えられる.
TRPM2の主な発現部位は,中枢神経,免疫細胞,脾臓,肝臓,膵臓など広範にわたる78).免疫細胞に発現するTRPM2はマクロファージにおけるケモカイン産生,貪食能に関与しており,好酸球ではサイトカインの遊離に関わっている80, 81).アレルギー反応に関与するマスト細胞においても,ヒスタミンの脱顆粒に関与しており,いわゆる花粉症や食物アレルギーなどの発症にも関係していると考えられる82).中枢における免疫応答を担う細胞であるミクログリアにも発現がみられ,脳虚血時の炎症や神経障害性疼痛の発症に関与している83, 84).我々は,膵臓β細胞にTRPM2が発現しており,インスリン分泌に寄与することを明らかにした85, 86).TRPM2欠損マウスはインスリン分泌低下による耐糖能異常(グルコース負荷によってより大きな血糖の上昇)を示す.さらにTRPM2欠損マウスは,小腸から分泌されるインクレチンホルモン(インスリン放出促進作用を有する)によるインスリン分泌が阻害されていた.TRPM2がグルコースならびにインクレチンホルモン刺激の下流で活性化されるメカニズムはいくつかある.TRPM2のリガンドであるcADPRはグルコース代謝の際に合成されるATPによってその分解が抑制され,細胞内濃度が上昇することが報告されている87).また,高濃度のグルコース存在下でβ細胞では過酸化水素などが生成されることが報告されている88).実際,上記の過酸化水素によるTRPM2依存的な温度依存性の増大はβ細胞でもみられ,インスリン分泌にも関係している89).EPAC2(exchange protein directly activated by cAMP 2)はインクレチンホルモン受容体シグナル分子の一つであるが,EPAC2活性化を介したインクレチンホルモン刺激により誘発されるβ細胞の活性化電流はTRPM2を介したものであることが示されており,TRPM2がEPAC2シグナルの下流で活性化されることが示唆されている90).細胞内Ca2+も含めて多くの刺激によってTRPM2活性は調節され,最終的なインスリン分泌量が決まると考えられる.一方で,高脂肪食を摂餌したときに生じる肥満ならびにインスリン感受性の低下は,逆にTRPM2欠損マウスでは生じにくくなる91).インスリン感受性の低下は白色脂肪組織などの炎症が要因の一つであるが,マクロファージに発現するTRPM2がインスリンの作用臓器である肝臓,白色脂肪組織へのマクロファージの浸潤ならびに引き続き起こる炎症を促進しているため,TRPM2欠損マウスでは肥満を呈しにくい可能性が報告されている.
近年,二つのグループから神経に発現するTRPM2についての報告がもたらされた.一つは,マウス視床下部視索前野の温ニューロン(温度の上昇により神経活性が増強する)へのTRPM2活性の関与を示すものである.視索前野神経の一部に熱刺激によって細胞内Ca2+濃度上昇を示すものがあり,その応答がTRPM2阻害剤(2-APB)で抑制され,TRPM2欠損細胞では消失した92).DREADDシステムを用いてTRPM2発現神経を活性化させると,行動量の低下と尻尾からの熱放出を伴う著しい体温低下が観察された.さらに,視床下部視索前野の局所加温により惹起される体温低下はTRPM2欠損マウスで減弱していたことから,視索前野TRPM2活性が体温低下に寄与すると考えられる93).しかしながら,視索前野温ニューロンはTRPM2欠損マウスでも消失しておらず,温ニューロンの温度感受性を担う分子は自身が発現するTRPM2分子ではない可能性が示された.温ニューロンを含む神経回路の中で最終的な温度感受性が決定されており,TRPM2はその一部を構成していると考えられる.もう一つは,末梢感覚神経のサブポピュレーションにTRPM2様の活性を示す神経群があるとする報告である.TRPM2欠損マウスの温度嗜好性は大きく変化しており,野生型が忌避する温かい温度域(38°C)と33°Cの弁別能がTRPM2欠損マウスにおいて消失していた94).
6)TRPM3
TRPM3は,ストア作動性陽イオンチャネルとしてクローニングされた95).感覚神経に発現するTRPM3は,侵害性熱刺激を感知して活性化し,痛みを引き起こすと報告された10番目の温度感受性TRPチャネルである96).少なくともHEK293細胞を用いた解析では,TRPV1やTRPM8のような明確な温度閾値を持たないようである.脂質平面膜法という精製タンパク質,人工脂質,電解質,水のみで構成される単純な人工再構成系においては,精製したTRPM3タンパク質の温度依存的な活性化はほとんどみられない97).温度以外では内因性活性物質と考えられる神経ステロイドである硫酸プレグネノロンによって活性化するが,その代謝産物であるプレグネノロンはむしろ阻害作用を持つ98).また,ニフェジピン(電位作動性Ca2+チャネル阻害剤),クロトリマゾール(抗真菌剤)等の薬剤によっても活性化される99).N末端にはカルモジュリン,S100Aが相互作用し,チャネル活性を調節することが報告されている100).この結合部位にPIP2も相互作用するようである101).TRPM3は,Ca2+透過性の高いチャネルであるが,一部のバリアント(TRPM3α1)ではNa+など一価の陽イオン選択性が高くなる102).これ以外にもTRPM3には多くのバリアントの存在が報告されており,エクソン13番目の一部の領域(ICF領域)の欠損しているバリアントは細胞膜へ発現しなくなると報告されているが103),それぞれのバリアント間の機能の違いはあまり明らかにされていない.
TRPM3は中枢,末梢神経,腎臓,膵臓などに発現している104).膵臓β細胞ではグルコース依存的なインスリン分泌を硫酸プレグネノロンが増強するが,この作用はTRPM3の活性化を介したものであると報告されている98).感覚神経ではTRPM3はTRPV1, TRPA1とは異なる神経に発現している.TRPV1よりも低い温度域の侵害熱刺激受容に関与すること,また炎症性疼痛における熱痛覚過敏に関与することがTRPM3欠損マウスの解析から明らかになっている96).また,CGRP(カルシトニン遺伝子関連ペプチド)含有神経に発現しており,TRPM3を活性化するとCGRPが分泌されることも報告されている105).オリゴデンドロサイトに発現するTRPM3は成熟やミエリン形成に関与している106).視覚への関与が示唆されており,特に網膜上のアストロサイト(ミューラー細胞)や毛様体に発現して,瞳孔反射に部分的に関与しているという報告されているが107),TRPM3欠損マウスの視覚処情報理は正常だという報告もあり108),生理的な役割は明らかではない.
7)TRPM4
TRPM4は,細胞内Ca2+によって活性化される非選択的陽イオンチャネルであるが,チャネル自身にCa2+透過性はない109).細胞内Ca2+以外に有効な活性化剤は見いだされていないが,細胞内Ca2+存在下において,温度が上昇するとその活性は大きく増強される110).TRPM4はPKA, PKCによるリン酸化部位,PHドメインなどを有している.特に,PKCによるリン酸化はTRPM4タンパク質の細胞膜へのトランスロケーションに関与することが報告されている111).
TRPM4は広範な組織細胞に発現する.TRPM4欠損マウスにおいて,細菌感染後の炎症性単球の増加,ならびにサイトカイン産生の亢進が認められている112).これは,細胞内カルシウム濃度上昇に伴って活性化されたTRPM4が膜を脱分極させることによって電位作動性Ca2+チャネルの活性を抑制し,さらなるCa2+流入を抑えるためと考えられている.TRPM4欠損マウスはβ受容体刺激による心室筋細胞における活動電位の潜時の短縮,心室筋細胞収縮力の亢進がみられている113, 114).また,心房筋の活動電位の調節や血管平滑筋の脱分極にも関与することが報告されている115, 116).神経,特に中枢神経に発現しているTRPM4は膜の興奮性を調節している可能性が示唆されており,小脳プルキンエ細胞ではTRPM4由来の細胞内Ca2+依存的なゆっくりとした内向き電流がみられると報告されているが117),TRPM4欠損マウスの解析からTRPM4の関与する可能性は少ないようである118).また,TRPM4は脳脊髄炎モデル(多発性硬化症モデル)マウスにおいて,軸索の変性に関与していることが報告されている118).膵臓においては,β細胞のみならずグルカゴン分泌細胞であるα細胞にも発現していることが報告されており119, 120),また,最近の報告では,消化管から分泌されるインクレチンホルモン(GLP-1)によるインスリン分泌増強作用にTRPM4が関与することが示された121).しかし,TRPM4欠損マウスの糖代謝は正常であり122),少なくとも生理的条件下ではインスリン,グルカゴン分泌への関与は少ないと考えられる.このように,TRPM4は多くの組織に発現がみられるが,その生理的役割はいまだ十分には明らかにはされていない.
8)TRPM5
TRPM5もTRPM4と同様に,細胞内Ca2+によって活性化される一価のイオン選択的な陽イオンチャネルである.15~35°Cの温度帯で活性が大きく上昇する123).TRPM4同様に温度依存的な活性化には細胞内Ca2+濃度の上昇が必要であるが,カルシウム感受性はTRPM4よりも高い124).TRPM4同様に細胞内Ca2+以外に有効な活性化剤は見いだされていない.
TRPM5の発現部位はTRPM4とは対照的に限局しており,味細胞,膵臓,嗅神経などに発現がみられる125).味細胞に発現するTRPM5は,甘味,うま味,苦味,特に甘みの受容に関与することが,TRPM5欠損マウスの解析から明らかになっている126).TRPM5はII型味細胞(甘味,うま味,苦味を受容する)にTASR1, TAST2, PLCβ, α-gastducinとともに発現しており,Gタンパク質共役型味覚受容体活性化の下流で産生されたIP3がERからのCa2+放出による細胞内Ca2+濃度上昇を引き起こすことでTRPM5を活性化する127).TRPM5の活性化によるNa+流入がもたらす脱分極が電位感受性のCALHM1(calcium homeostasis modulator 1)を介した神経伝達物質ATPの放出を引き起こす128).熱刺激によるTRPM5の活性化がマウスの甘味応答を増強するという123).温度味覚(thermal taste)にも関わっているかもしれない.また,人工甘味料ステビアによる甘味にもTRPM5が関与する129).TRPM5は脂肪の味にも関与すると報告されている130).マラリアの特効薬キニーネは苦味物質として知られているが,濃度依存的にTRPM5を抑制することが知られており131),苦味感覚を増強することになる.
TRPM5は膵臓の特にβ細胞に発現しており,TRPM5欠損マウスはインスリン分泌低下を伴う糖代謝異常がみられることが報告され132, 133),インスリン分泌に関与していることが明らかとなっている.β細胞からのインスリン放出には細胞内カルシウム濃度の変動(slow and fast oscillation)が必要で,それらは膜電位変化のオシレーションと共役しているとされており,TRPM5欠損β細胞ではfast oscillationが欠如しているという133).β細胞の細胞内カルシウム濃度依存的な膜電位変化にTRPM5は関わっているものと推定される.グルコース依存的なインスリン放出のGLP-1による増強作用もTRPM5欠損β細胞では有意に低下する121).最近,甘味受容体が膵臓β細胞にも発現していることが報告されており134),味細胞でみられるようなシグナル伝達機構がβ細胞にも存在するかもしれない.
マウスの一部の嗅上皮の嗅神経や鋤鼻器にもTRPM5は発現しており,フェロモン受容に関与していることが報告されている135).また,消化管や鼻腔上皮のbrush細胞やtuft細胞にもPLCβ, α-gustducinとともにTRPM5が発現しており,免疫,炎症への関与が指摘されている136–138).
我々は,HEK293細胞に発現させたTRPM5電流が細胞外亜鉛イオンにより抑制されることを報告した139).この効果は温度依存性のTRPM5活性化においても認められた.細胞外の負電荷を持つアミノ酸に注目した解析の結果,TRPM5のポアループに位置するHis896, Glu926, Glu939が亜鉛による抑制に関わることが明らかとなった.
9)TRPM8
TRPM8はハッカ油の主成分であるメントールを用いた発現クローニング140),もしくはTRPV1配列との類似性141)から同定された非選択性陽イオンチャネルである.チャネルを活性化させるための有効刺激は,非侵害性の冷刺激(23~26°C以下)(図3),侵害性冷刺激(15°C以下),メントールやユーカリプトール(ユーカリ由来成分)などの天然化合物,イシリンなどの合成化合物であり,いずれも冷感を惹起させる.またチャネル活性の維持にPI(4,5)P2が重要であり142),TRPM8活性による細胞内Ca2+濃度上昇とPLCγ活性化により,PI(4,5)P2が加水分解されるとTRPM8電流が抑制される.有効刺激間の相乗作用が存在し,メントールなどの存在下では活性化温度閾値が上昇する(より高い温度を冷たいと感じる).
TRPM8は三叉神経節および後根神経節の一次感覚神経のうち小型の神経細胞に発現する.TRPM8は,TRPV1/TRPA1神経とは異なる神経群に発現しており,皮膚などからの冷情報を中枢に伝達する役割を担い,体性感覚における冷受容体として機能すると考えられる.TRPM8欠損マウスは,非侵害性冷刺激に対する応答と,一部の侵害性冷刺激に対する応答を消失するとともに143–145),温度勾配を用いた温度嗜好性実験において,野生型マウスよりもやや低温よりに分布していた145).一方TRPM8発現細胞を除去したマウスを用いて床温度が異なる二つの部屋のいずれに滞在するかを検討した実験において,TRPM8発現神経除去マウスは低温を忌避しなかったことから146),TRPM8発現神経は非侵害性ならびに侵害性の低温受容に関わっていると考えられる.一方で温かい温度の受容において,感覚神経におけるTRPM8活性の抑制が重要であるとの報告がなされた147).
我々は,TRPM8細胞が置かれている環境温度によって結合可能なPI(4,5)P2の量もしくはTRPM8への結合能が変わり,結果的にTRPM8の活性化温度閾値が変化することを報告した148).冷たい温度に浸した手を室温の水に浸けると温かく感じ,温かいお湯に浸けた手を室温の水に浸けると冷たく感じること(Weberの3ボトル実験と呼ばれる)を説明できるかもしれない.
また,TRPM8活性化が,神経障害性疼痛および慢性疼痛時における痛覚の抑制144, 145, 149)や全身性の炎症の抑制150)に関与することが報告されている.TRPM8のその他の生理機能として,目の表面の低温を認識し涙の量を調節したり151),高浸透圧を認識してまばたきの数を調節したりするのではないかといった報告もある152).
10)TRPA1
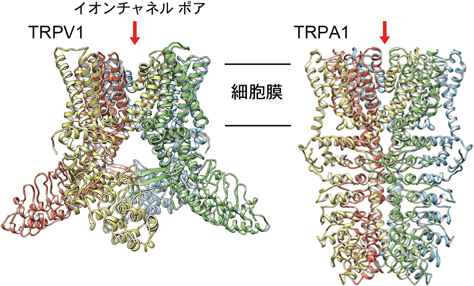
17°C以下の侵害性冷刺激によって活性化される新たな温度感受性TRPチャネルとして2003年に報告されたTRPA1は,感覚神経細胞においてTRPV1との共発現が観察される153).TRPA1はマスタードオイル,活性酸素種,アルデヒドなど,遺伝子やタンパク質への障害を生じさせる広範な物質や,Ca2+イオン,Zn2+イオン等により活性化し,侵害刺激受容に関与する.我々は,アンモニアや細胞内アルカリ化もまたTRPA1を活性化することを明らかにした154).数多くの薬剤による活性化も知られ,血管痛が副作用として知られる静脈麻酔薬プロポフォールもヒトTRPA1を活性化する155).構造の異なる多くの化学物質が作用するメカニズムの一つとして,N末端のシステイン残基の共有結合修飾があげられている156).
TRPA1の温度感受性に関しては,長らく議論されてきた.マウス・ラットTRPA1は低温感受性であるがヒトTRPA1は感受性がないとの,種差を示す報告がある157).一方で,人工脂質二重膜を用いた解析でヒトTRPA1が冷刺激によって活性化されることが示された6).このTRPA1の冷刺激感受性を示すメカニズムとして,冷刺激で活性酸素種が生成するとTRPA1 N末端のプロリン水酸化が阻害されてTRPA1活性化が増大することが報告された158).近年,侵害性冷刺激受容におけるTRPチャネルの関わりに関する興味深い報告がなされ,象牙芽細胞に発現するTRPA1がTRPC5とともに冷刺激により惹起される歯痛に関わることが示された(後述)159).またTRPA1は非脊椎動物を含む広範な生物種において,侵害性熱刺激の受容に関わる(後述)160).哺乳類であるマウスにおいても,TRPA1がTRPV1およびTRPM3とともに侵害性熱刺激受容に重要であることを示す報告がなされた.前述のとおり侵害性の熱に感受性を持つTRPV1およびTRPM3を欠損するマウスは,侵害性熱刺激に対する応答性が減弱するものの完全には消失しない14, 96).同様にTRPV1およびTRPM3の両者を欠損するマウス(V1/M3 DKO)感覚神経において,熱刺激に対する応答性が維持されており,その熱刺激応答性がTRPV1, TRPM3およびTRPA1の三つを欠損するマウス(TKO)神経において消失することが示された161).さらには,TKO感覚神経へのTRPA1遺伝子導入により熱刺激応答が再現されたことから,TRPA1は感覚神経における熱刺激受容を担う分子であると考えられる.TRPA1活性化剤(AITC,アリルイソチオシアネート)に対する応答性を示すV1/M3 DKO感覚神経における熱刺激応答および異所性発現系におけるTRPA1の熱刺激応答が過酸化水素処置により増大したことから,熱刺激受容におけるTRPA1の寄与は炎症などの環境要因により変動する可能性が示唆される.
我々は,マウス後根神経節を用いたRT-PCR実験から,TRPA1遺伝子にエクソン20を欠いたスプライスバリアントを同定した.このスプライスバリアントTRPA1bは完全長のTRPA1(TRPA1a)と結合して細胞膜のTRPA1a発現量を増大させ,TRPA1応答電流を増強することがわかった162).CFAを用いた炎症性疼痛モデルや座骨神経の部分結紮による神経障害性疼痛モデルで増強する機械刺激による痛覚は,野生型マウスと比較してTRPA1欠損マウスで減弱したことから,TRPA1が炎症性疼痛や神経障害性疼痛の慢性疼痛に関与すると考えられる.さらに,TRPA1a遺伝子はその発現が一過性にしか増大しないが,一方TRPA1b遺伝子発現は持続的に増大することから,マウスTRPA1スプライスバリアントが慢性疼痛発生に関わると考えられる.
TRPA1タンパク質はTRPV1とともに感覚神経細胞体で発現後,末梢神経終末のみならず一次求心性線維の中枢端(脊髄のシナプス前終末)にも輸送される.脊髄のシナプス前終末でのTRPV1, TRPA1活性は侵害刺激情報のシナプス伝達にどのように働くであろうか? 増大するCa2+流入がシナプス伝達物質の放出に促進的に働くと想像しやすいが,長く鎮痛薬として使われ2011年に成人への用量拡大が認められたアセトアミノフェンの代謝産物が脊髄のTRPA1を活性化させて鎮痛をもたらすことが報告され注目を浴びた163).TRPA1活性化による脱分極が電位作動性Na+, Ca2+チャネルイオン透過の電気化学的駆動力を減弱させシナプス伝達物質の放出を減少させるのだという.今後の研究が注目される.
11)TRPC5
2011年にTRPC5ホモ四量体が冷刺激による活性化を受けることが報告された164).感覚神経へのTRPC5発現が示されたものの,TRPC5欠損マウスを用いた検討でも冷刺激に対する忌避応答に変化が認められず,TRPC5の温度感受性については不明であった.しかしながら,冷刺激により惹起される歯痛に注目した最近の研究により,神経ではなく象牙芽細胞に発現するTRPC5がTRPA1とともに冷刺激感受性に関わることが報告された159).ヒトの歯髄炎においてTRPC5発現の亢進が認められ,臨床上問題となる歯痛の治療ターゲットとしての可能性も考えられる.