CAPS2タンパク質によるオキシトシンの分泌制御とマウス社会行動CAPS2 regulates oxytocin secretion and is associated with social behavior in mice
1 東京理科大学理工学部応用生物科学科Department of Applied Biological Science, Faculty of Science and Technology, Tokyo University of Science ◇ 〒278–8510 千葉県野田市山崎2641 ◇ 2641 Yamazaki, Noda, Chiba 278–8510, Japan
2 神戸大学大学院医学研究科博士課程Kobe University Graduate School of Medicine ◇ 〒650–0017 兵庫県神戸市中央区楠町7–5–1 ◇ 7–5–1 Kusunoki-cho, Chuo-ku, Kobe-shi, Hyogo 650–0017, Japan

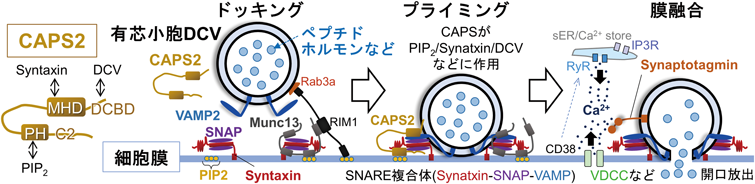
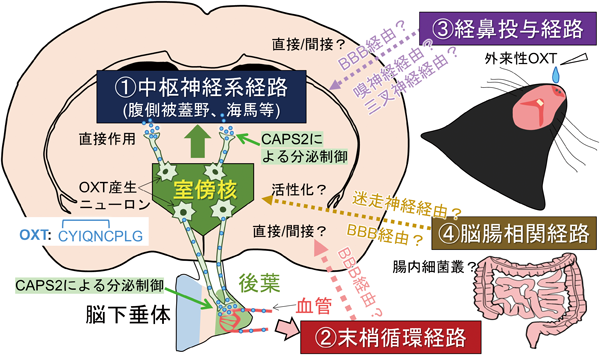
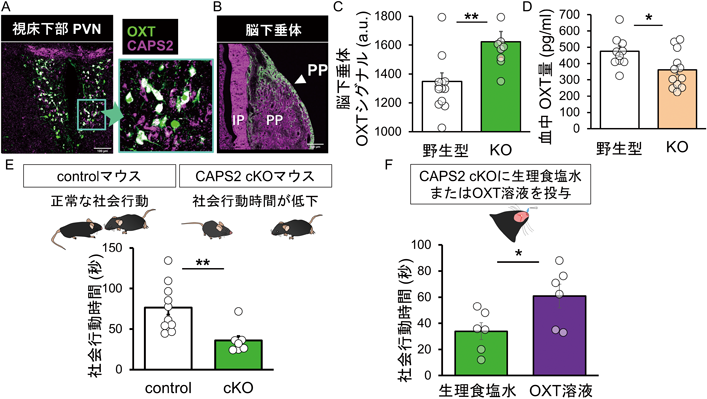


 .
.