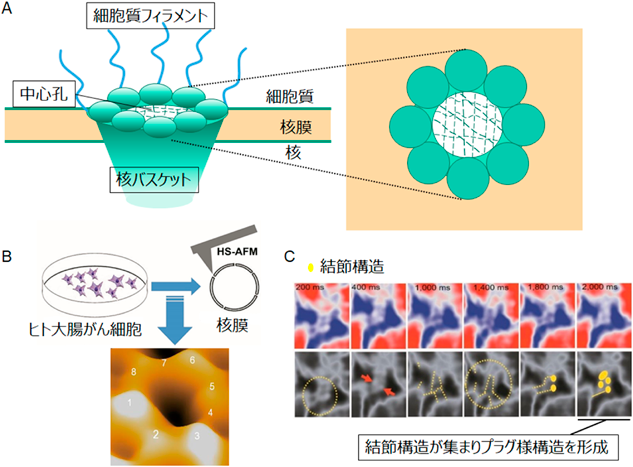
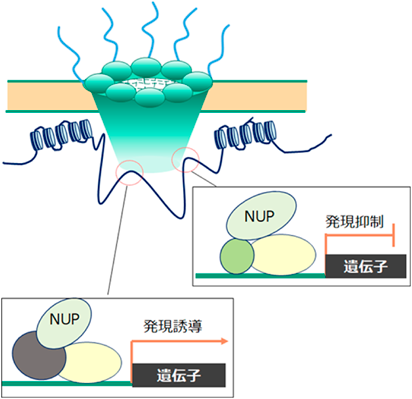
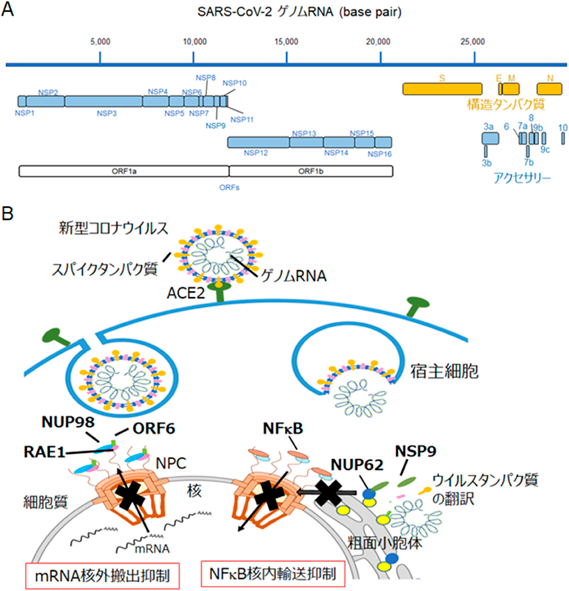
核膜孔複合体の動態と新たな機能Structural dynamics and new function of nuclear pore complexes
1 金沢大学新学術創成研究機構Institute for Frontier Science Initiative, Kanazawa University ◇ 〒920–1192 石川県金沢市角間町 ◇ Kakuma-cho, Kanazawa, Ishikawa 920–1192, Japan
2 金沢大学ナノ生命科学研究所WPI Nano Life Science Institute, Kanazawa University ◇ 〒920–1192 石川県金沢市角間町 ◇ Kakuma-cho, Kanazawa, Ishikawa 920–1192, Japan
3 金沢大学生命理工学類College of Science and Technology, Kanazawa University ◇ 〒920–1192 石川県金沢市角間町 ◇ Kakuma-cho, Kanazawa, Ishikawa 920–1192, Japan