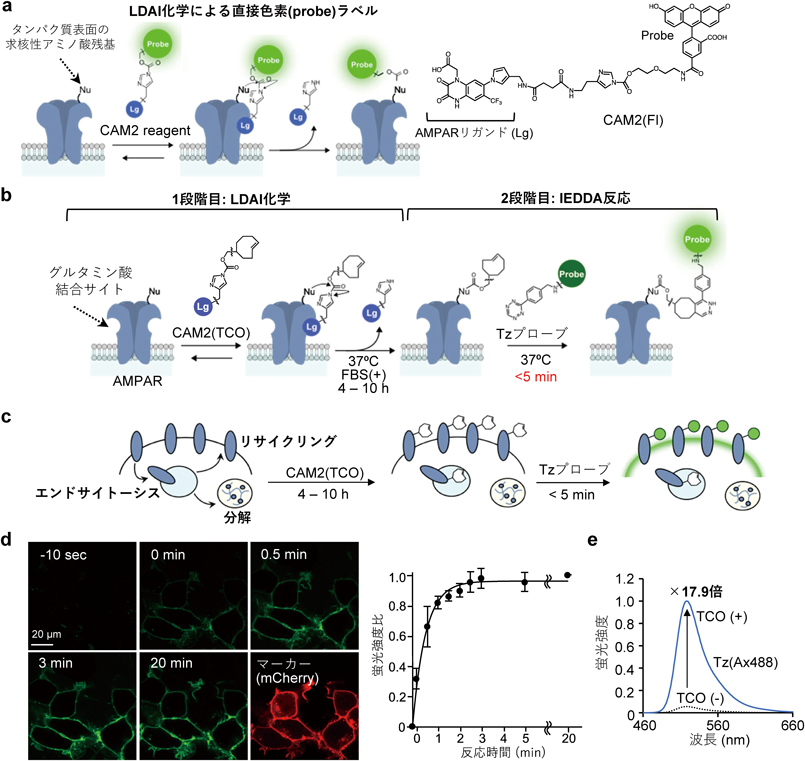
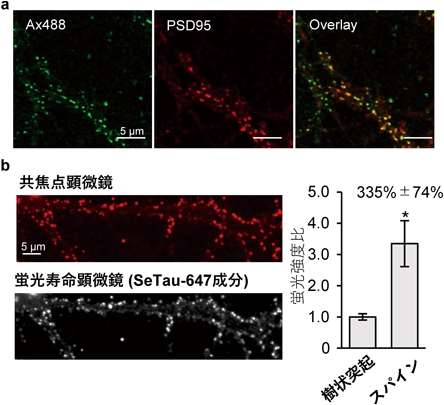
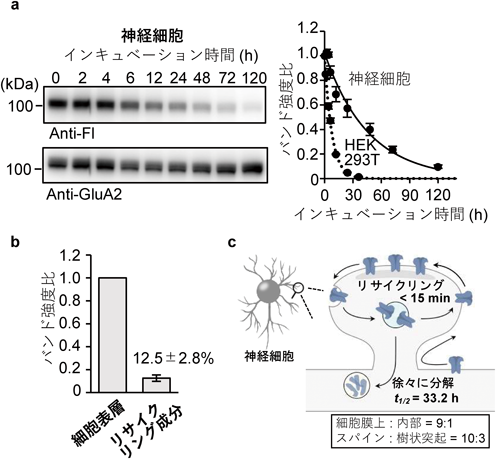
迅速ケミカルラベル化法によるAMPA型グルタミン酸受容体の精密動態解析Two-step chemical labeling to quantify AMPA receptor trafficking in neuron
名古屋大学大学院工学研究科生命分子工学専攻Department of Biomolecular Engineering, Graduate School of Engineering, Nagoya University ◇ 〒464–8603 名古屋市千種区不老町 ◇ Furo-cho, Chikusa-ku, Nagoya 464–8603, Japan