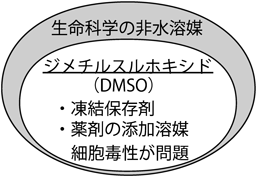
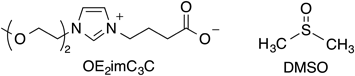
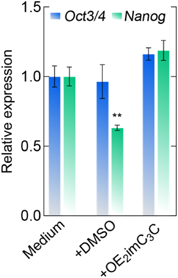
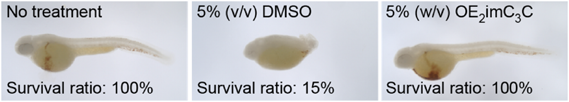
生命科学のための新規溶媒:DMSO依存からの脱却Novel solvents for life sciences
1 金沢大学理工研究域生命理工学系,ナノマテリアル研究所Faculty of Biological Science and Technology, Institute of Science and Engineering, Kanazawa University/NanoMaterials Research Institute, Kanazawa University ◇ 〒920–1192 石川県金沢市角間町 ◇ Kakuma-machi, Kanazawa, Ishikawa 920–1192, Japan
2 金沢大学がん進展制御研究所,ナノ生命科学研究所Cancer Research Institute, Kanazawa University/WPI-Nano Life Science Institute, Kanazawa University ◇ 〒920–1192 石川県金沢市角間町 ◇ Kakuma-machi, Kanazawa, Ishikawa 920–1192, Japan