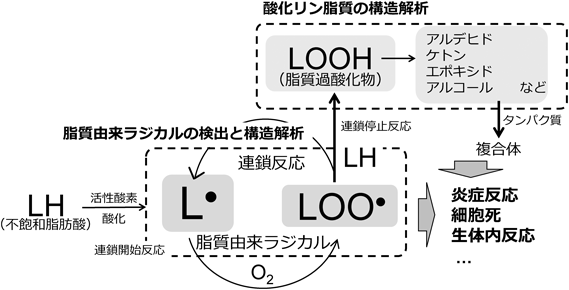
検出方法について述べる前に,脂質過酸化反応について簡単に記載する.不飽和脂肪酸は,酸化反応を受けやすい.これは,不飽和脂肪酸内bis-allylic carbonsの水素原子の結合乖離エネルギーが,一般的なアルキル基のC-H結合(約100 kcal/mol)に比べて小さいことによる11).そのため,以下のような脂質過酸化連鎖反応が生じる(図1).
- (1)不飽和脂肪酸(LH)から水素原子が引き抜かれ「脂質由来炭素中心ラジカル(L·)」が生成し,連鎖反応が開始.
- (2)生成したL·は,直ちに溶存酸素分子と反応し(kperox=109 M−1 s−1)12),脂質ペルオキシルラジカル(LOO·)を生成.
- (3)LOO·は,周囲の不飽和脂肪酸から水素原子を引き抜き,脂質ペルオキシド(LOOH)とL·を生成し,酸化障害が伝搬する(kp=101–2 M−1 s−1)13).
- (4)その後,LOOHは脂質ペルオキシルラジカルやアルコキシルラジカルなどの酸素中心ラジカルに開裂し,フリーラジカル反応が広範に伝幡する.さらに,生成した脂質由来酸素中心ラジカルは,4-ヒドロキシ-2-ノネナールなどのアルデヒド体,またケトンやエポキシド体などへと分解される.
このように不飽和脂肪酸はひとたび酸化されると,脂質由来ラジカルが常に存在している状態となり,脂質過酸化代謝産物が大量に生成されることになる.加えて,リン脂質は生体内において,疎水性相互作用により密集(凝集)し存在することから,これら連鎖的伝搬反応は急激に拡大する.また,位置異性体,立体異性体,などを考慮すると,酸化リン脂質の数は数百種類存在するであろう14).さらに,反応性が高く,それ自身が細胞毒性や変異原性を有する.加えて,アルデヒド体は,活性酸素種よりも生体内半減期が長く,細胞内外へ拡散できる.近年では,これらアルデヒド体とタンパク質との複合体が疾患と密接に関連することも報告されている.
このように,脂質過酸化反応は脂質由来ラジカル形成という質的変化の一点に端を発するが,脂質分子の機能障害,過酸化物の蓄積,さらにはタンパク質複合体形成など多様な病態ステージに影響を及ぼしていることになる.これら脂質過酸化物やその代謝産物と疾患との関連を解析するためには,やはり検出技術開発が不可欠である.これまで,脂質過酸化物やその代謝産物であるアルデヒド体およびそのタンパク質複合体については,質量分析装置を用いた検出15, 16)や抗原抗体反応を利用した方法17)など,有用な手法が数多く報告されている.そこで,脂質由来ラジカルおよび脂質過酸化産物の測定などについて述べる.
1)スピントラップ法
L·やLOO·などの脂質由来ラジカルは,脂質過酸化連鎖反応の中心であり,反応性がきわめて高い.現在報告されている代表的な測定法としては,1)スピントラップ法,2)蛍光プローブ法,の二つがあげられる.1)スピントラップ法とは,ラジカル種を安定な反応付加体へと誘導体化を行う方法である.たとえば,N-tert-butyl-α-phenylnitrone(PBN)やα-(4-pyridyl-1-oxide)-N-tert-butylnitrone(POBN)といったニトロン化合物は,特に炭素中心ラジカル種と反応し,より安定なラジカル付加体を形成する.これら付加体を,電子スピン共鳴装置にて検出し,さらにliquid chromatography-tandem mass spectrometry(LC/MS/MS)を組み合わせることで,脂質由来ラジカルの構造解析が可能となる.実際に,Qianらは,ω6系不飽和脂肪酸のリノール酸とアラキドン酸,あるいはω3系のリノレン酸とドコサヘキサエン酸の,酵素酸化反応において生成する脂質由来炭素中心ラジカルの検出に成功している18, 19).
2)蛍光プローブ法:BODIPY骨格のプローブ
近年では,抗酸化分子の高い酸化還元応答性を利用した脂質由来ラジカル検出蛍光プローブの開発も進められている.このプローブでは,先のスピントラップ法とLC/MS/MSの組合わせで得られるような脂質由来ラジカルの構造情報を得ることはできない.しかし,高感度な蛍光分析法であり,細胞イメージングも可能であることから,幅広く応用されている.
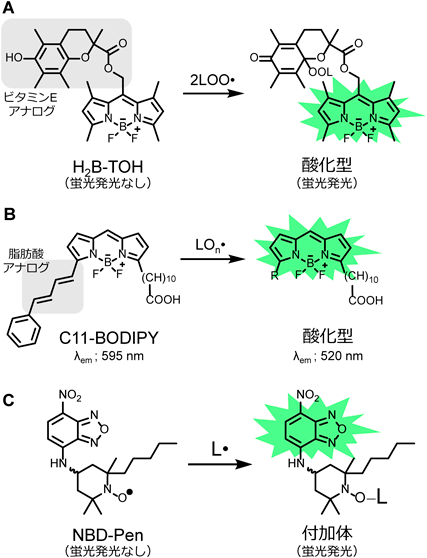
Krumovaらは,フェノール性抗酸化分子[chromanol(ビタミンEの活性部位)]の酸化還元電位が脂質由来ラジカル(特にLOO·)と反応前後で大きく変化することに着目し,これらを蛍光スイッチとした脂質由来ラジカル検出蛍光(BODIPY based)プローブ,H2B-TOHを開発した20, 21)(図2A).本プローブは,通常,抗酸化分子部位からBODIPYへの光誘起電子移動(PeT)により消光しているが,反応後抗酸化分子部位のHOMOレベルが低下するため,PeTが起こらず発光する20).また,蛍光プローブの特徴を生かし,培養細胞内脂質由来ラジカルの蛍光イメージング22)や,脂質由来ラジカルと抗酸化分子との反応の速度論的解析23)も進められている.
一方,Drummenらは,抗酸化分子であるカロテノイドとBODIPYを連結させたratio metric蛍光プローブC11-BODIPYを報告した24)(図2B).本プローブは,カロテノイドとBODIPY部位とのπ電子共役が,ラジカル反応により切断されることで,励起蛍光波長が大きくシフトする[595 nm(非酸化型)/520 nm(酸化型)].このような光応答性を利用することで,培養細胞中の脂質由来ラジカルの解析も可能である.このC11-BODIPYとペルオキシルラジカルとの反応速度は,6.0×103 M−1s−1と推定されている25).一方,本プローブは,近年精力的に研究が進められているフェロトーシス1)の研究分野において広く利用されており,培養細胞中脂質由来ラジカルの蛍光イメージングも可能である26, 27).さらに最近では,これら上記のプローブに,ミトコンドリア移行性を付与した蛍光プローブも開発されている28, 29).
3)蛍光プローブ法:NBD-Pen
上述した手法は非常に有用であり,多くの研究に利用されている.一方で,動物実験などへの応用研究,また脂質由来ラジカルの構造情報などについては,さらなる改良が必要である.そこで我々は,脂質由来ラジカルを直接捉え,かつ蛍光イメージング可能な検出プローブの開発を進めた.まず,着目したのが,分子内に安定な不対電子を有する有機スピン化合物,ニトロキシド化合物である.このニトロキシド内の不対電子は,水溶液中でも安定に存在する(代表的なニトロキシドであるTempolは,少なくとも数か月間水溶液中で安定に存在している).ニトロキシドと炭素中心ラジカルとの反応は,主にlaser flash photolysisや熱分解性アゾイニシエーターを用いて速度論的解析が進められている30).一般的にニトロキシド化合物は,特に炭素中心ラジカルときわめて高い反応性(拡散律速反応に近い速度,k=108–9 M−1 s−1)30–32)を有し,スピントラップ剤と炭素中心ラジカルとの反応(k=105 M−1 s−1程度)33, 34)に比べてはるかに大きく,酸素分子35)とほぼ同程度の反応性である.また,ニトロキシド内のラジカルと炭素中心ラジカルとの反応は,ラジカル–ラジカルカップリング反応であり,より安定なアルコキシルアミン付加体を形成する36).こうした反応特性より,ポリマー化学の研究分野における光安定剤(ヒンダードアミン光安定剤の活性種)をはじめ37),生物物理学におけるスピンプローブ,有機化学における合成反応中間体の解析,さらには抗酸化物質などとしても応用されている38).
代表的なニトロキシド化合物であるTEMPOは,炭素中心ラジカル種に対して高い反応性を示す一方で,アスコルビン酸などの抗酸化分子とも反応し39, 40),非常磁性のヒドロキシルアミンへと還元される(k=101–2 M−1 s−1).これら抗酸化分子はラジカル分子よりも生体内に多く存在するため,ラジカル解析の障害となりえる.そこで我々は,ピペリジン系ニトロキシドのα位への置換基修飾合成法を開発し41),脂質由来ラジカルに対して高い反応選択性を有するニトロキシド誘導体を開発した42).また,ニトロキシドは周囲に存在する蛍光原子団をスピン交換や光誘起電子移動により消光させる43–45)ことから,酸化還元物質に対する蛍光プローブの発光制御部位としても活用されている46).
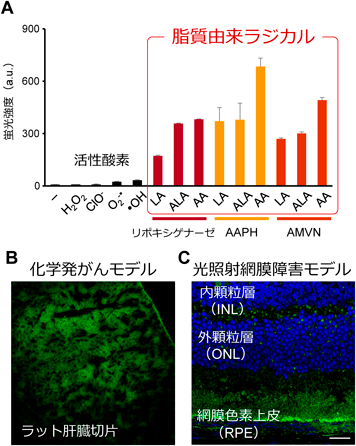
以上の点を踏まえ,我々は,脂質由来ラジカルと反応し付加体形成することで蛍光発光するプローブ「NBD-Pen」を開発した47)(図2C).本プローブは,過酸化水素や,スーパーオキシド,ヒドロキシルラジカルなどの活性酸素とは,ほとんど反応しない(図3A).一方で,リノール酸(LA),αリノレン酸(ALA),アラキドン酸(AA)などを基質とし,リポキシゲナーゼや,AAPHやAMVNなどアゾ化合物の刺激により生成した脂質由来ラジカルと反応し,蛍光発光する(図3A).このとき,NBD-Pen蛍光強度は,ほぼAA>ALA>LAの順であったが,これはおそらく基質である不飽和脂肪酸内の二重結合の数の差によるためであろう.
では,NBD-Penは,本当に脂質由来ラジカルと反応して蛍光発光しているのであろうか? 本プローブのn-オクタノール/水分配係数(log Po/w)は2.46であり47),用いた蛍光団NBD基は環境応答性蛍光団である.以上から,本プローブの大部分は,少なくとも脂溶性環境下に存在していると考えられる.一方で,本プローブは,10 µMまでの濃度でHepG2細胞などに対して毒性を示さない.さらに本プローブの特徴は,動物モデルの組織切片中での蛍光イメージングが可能な点である.以下,実際に疾患動物モデルで脂質由来ラジカルを検出した結果を示す.
化学発がん物質であるジエチルニトロソアミンは,シトクロムP450で代謝され,その際に炭素中心ラジカルが生成することが報告されている48, 49).このジエチルニトロソアミンを動物に投与し,1時間後にNBD-Penを腹腔内投与した.その後肝組織切片を作成し,蛍光イメージングを行ったところ,蛍光強度が有意に増加し(図3B),P450阻害剤であるSKF525Aの投与で蛍光強度は減弱した.さらに,別の疾患モデル動物として,網膜障害モデルでの例を示す.眼,特に網膜組織ではドコサヘキサエン酸などの不飽和脂肪酸が多く存在する50).さらに網膜組織は酸素消費量が高く51),常に光を浴びており,網膜障害への酸化脂質の関与が想定されている.そこで,光照射網膜障害モデル動物を作製し,NBD-Penを投与したところ,網膜切片中での蛍光強度が上昇し(図3C),脂質由来ラジカル阻害剤の投与で蛍光強度は有意に減弱した52).このことから,脂質由来ラジカルは確かに疾患モデル動物でも生成しているといえる.その他,酸化LDL中での検出も可能であった53).
4)脂質由来ラジカルは疾患発症の原因か?
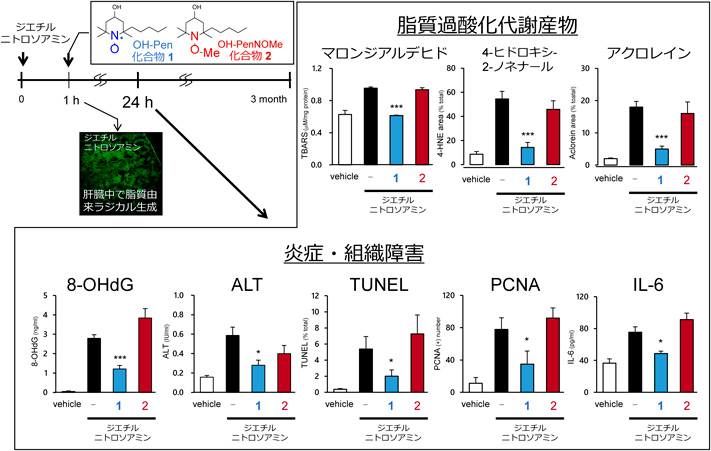
では,生体内で生成した脂質由来ラジカルは,疾患を誘発,あるいは進展する原因分子なのであろうか? それとも結果として生成した産物なのだろうか? もし,原因であれば,脂質由来ラジカルの捕捉により,疾患発症や進展は軽減されるはずである.そこで,NBD-Penの蛍光団を外した脂質由来ラジカル捕捉剤OH-Pen(化合物1),あるいは脂質由来ラジカルとの反応性をブロックしたOH-PenNOMe(化合物2)を新たに合成した47).先に述べたように,ジエチルニトロソアミン投与1時間後に脂質由来ラジカルが生成していることを,NBD-Penを用いて示した(図3B).そこで,ジエチルニトロソアミン投与1時間後にNBD-Penの代わりにOH-Penを動物に投与したところ,ジエチルニトロソアミン投与で上昇した肝組織中の酸化脂質由来アルデヒド体であるマロンジアルデヒド,4-ヒドロキシ-2-ノネナール,アクロレイン,また炎症や細胞死のマーカーである8-OHdG, ALT, TUNEL, PCNA, IL-6,いずれも有意に減少した47)(図4).しかしながら,脂質由来ラジカルと反応性を持たないOH-PenNOMeの投与では,抑制効果はまったくなかった.さらに,ジエチルニトロソアミン投与1時間後にOH-PenあるいはOH-PenNOMeを一度投与し,そのまま3か月間動物を飼育したところ,ジエチルニトロソアミン投与で上昇した肝foci数は,OH-Pen投与で有意に減少した(図5A).一方で,OH-PenNOMeでは効果はまったくなかった.興味深いことに,NBD-Penで蛍光強度の上昇がみられなかったジエチルニトロソアミン投与24時間後にOH-Penを投与しても肝foci数はほとんど変わらない.以上の結果は,ジエチルニトロソアミン投与初期に脂質由来ラジカルが生成し,何らかの経路により肝発がんの原因になりうることを示すものである.また,同様の検討を先の光照射網膜障害モデル動物でも実施し,脂質由来ラジカル捕捉剤の投与で網膜障害を有意に軽減することも明らかにしている52)(図5B).
これまで脂質過酸化反応の連鎖反応の起点である脂質由来ラジカルが疾患に関与していることが想定されていた.しかし,それを証明する適切な手法は,特に動物実験では制限されていたように思われる.今回,脂質由来ラジカルが生成している時期に阻害剤を投与すれば疾患発症を軽減できることがわかり,脂質由来ラジカルの疾患発症への関与,あるいは阻害剤投与タイミングに関する情報が得られたのではないかと考えている.なお,今回OH-Penを用いた検討を紹介したが,蛍光プローブでも同様に疾患の発症を軽減できる.
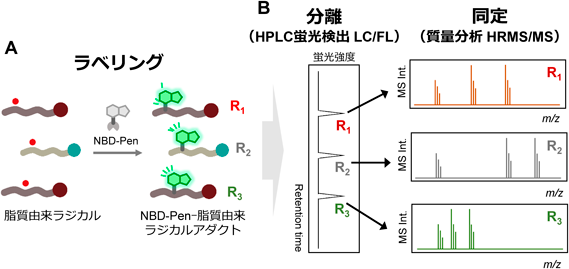
5)脂質由来ラジカルの構造解析
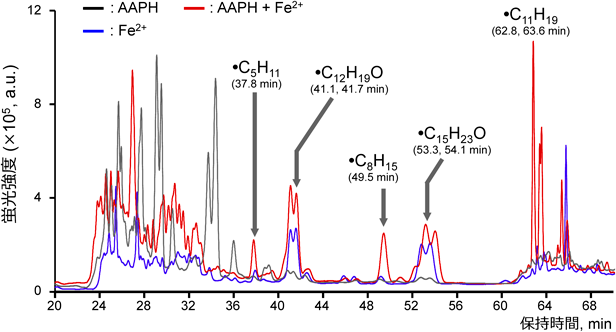
脂質由来ラジカルが化学発がんや光照射網膜障害モデル動物の発症に関与することがわかった.では,それら疾患に関与すると考えられる脂質由来ラジカルの構造情報はどのようなものであろうか? NBD-Penの開発コンセプトは,脂質由来ラジカルとラジカル-ラジカル反応により共有結合を形成するということである47).そのため,NBD-Pen内の不対電子が消失し,蛍光発光する.すなわち,NBD-Penは,脂質由来ラジカルと反応し蛍光性付加体を形成する.このことは,この付加体を高速液体クロマトグラフィー(HPLC)にて分離し蛍光検出にて保持時間を確定,その保持時間で質量分析を行えば,結合した脂質由来ラジカルの構造を解析できるはずである54)(図6).そこで,先の実験と同様に,NBD-Penをアラキドン酸/リポキシゲナーゼと反応させ,HPLCにて蛍光検出したところ,クロマトグラムのうちに複数の蛍光ピークが観察された.このピークは,リポキシゲナーゼの濃度依存的に上昇した.また,リポキシゲナーゼ阻害剤の添加により有意に減弱した.そこで,刺激の種類により蛍光ピークの強度が変わるどうかを検討した.アゾ化合物であるAAPH,あるいは二価鉄,さらにその組合わせで刺激したところ,クロマトグラム中の蛍光ピーク強度が刺激の種類によって大きく変動した(図7).そして,蛍光強度が上昇した保持時間で溶出される物質に対して質量分析を行ったところ,·C5H11や·C12H19Oなど炭素鎖が短い断片化ラジカル体が複数生成していることがわかった.
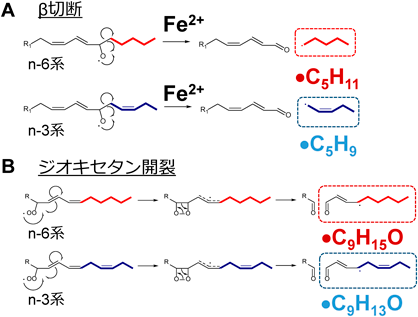
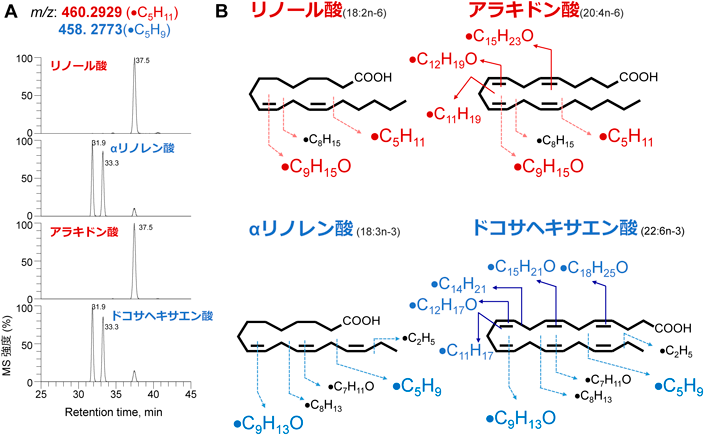
では,基質であるアラキドン酸からどのようにして炭素鎖が短い断片化ラジカルが生成したのであろうか? これまで,たとえば,β切断ではアルキルラジカルが,またジオキセタン開裂やホック開裂では,オキソアルケニルラジカルが生成するなど,生成機構がいくつか報告されている55)(図8).さらに,用いる基質としてアラキドン酸の代わりにω3系のドコサヘキサエン酸などを用いた場合には,二重結合の位置が異なるため,生成する断片化ラジカルの質量が水素2個分違うことが想定される.そこで,これらの開裂パターンから,生成するであろう断片化ラジカルパターンを推測し,質量分析を行った54).また,重水素化した脂肪酸も利用した.その結果,たとえばリノール酸やアラキドン酸などのω6系では,·C5H11や·C9H15Oが,一方αリノレン酸やドコサヘキサエン酸などのω3系では,·C5H9や·C9H13Oなどの質量が水素2個分小さい脂質由来ラジカルが生成していた(図9).またMSピークエリアから生成したラジカル量を半定量すると,刺激の種類によって生成するラジカル種が大きく異なっていた.現時点で,実際に測定できた脂質由来ラジカルは132種類であり,そのうち111種類はこれまで報告がない新規のラジカルであった.
以上の結果より,脂肪酸の酸化により断片化ラジカルが複数生成していること,またその生成機構はβ切断やジオキセタン開裂であり,検出した断片化ラジカル体から開裂パターンを推測できることが示唆された.さらに基質である脂肪酸がω3系かω6系かを区別することもできそうである.そこで,実際に疾患モデル動物において,どのような脂質由来ラジカルが生成しているか測定した.その結果,ジエチルニトロソアミン投与1あるいは4時間後に断片化ラジカルが合計12種類有意に生成しており,阻害剤OH-Penの投与により減少した54).また,その多くはアルキルラジカルであった.さらに,そのMSピークエリアから半定量したところ,大部分はω6系由来ラジカルであった.
このように脂質由来ラジカルの検出・構造解析が可能になった.しかし,検出できた物質は分子式にとどまっており,立体構造などは不明である.また標品がないため,半定量にとどまっている.今後,重要な分子については,標品の合成などが必要であろう.一方で,以前より,酸化ストレス疾患などで,呼気中に揮発性炭化水素の生成が報告されている56, 57)が,これは,これら断片化ラジカルから生成しているのかもしれない.
1)酸化リン脂質の構造ライブラリー
脂質由来ラジカルの検出および構造解析を通じて,これら分子が疾患の発症などに関与している可能性が示された.では,脂質過酸化連鎖反応の代謝産物である酸化脂質の検出は可能であろうか? そこで我々は,細胞膜の構成成分であり,代謝,シグナル伝達の調節など,重要なプロセスに関与しているグリセロリン脂質に着目した.リン脂質は,多価不飽和脂肪酸を含むため,容易に酸化されて酸化リン脂質を生成する.特に肝臓や腎臓に豊富に存在するホスファチジルコリン(PC)由来のoxPCsは,細胞死や炎症反応に関与している.こうした酸化リン脂質は,エポキシドや,ヒドロキシド,ヒドロペルオキシド,アルデヒド,カルボン酸など,構造が多様な物質へと分解される(図1).しかしながら,実際に動物モデルや臨床試料から検出される内因性oxPCsの数は,予想よりもはるかに少ない.現在,脂質データベースであるLIPID MAPS(www.lipidmaps.org/)に登録されているoxPCsは,53種類である.この報告されている酸化リン脂質の数の少なさは,酸化リン脂質が複雑なラジカル反応を経て生成した微量物質であり,そのためその化学構造の推定が難しく,測定が困難なことに起因する.しかし,酸化脂質の生成機構を考えると,その数が非常に多いことが容易に想像できる.また,脂質過酸化連鎖反応の起点である脂質由来ラジカルが少なくとも132種類検出できた54)ことを考えても,多くの酸化リン脂質が生成しているのは間違いない.実際に,Anthonymuthuらは,既知の脂質構造から生成しうる総数と比較して,同定された酸化脂質の数はごくわずかであると述べている58).
これら酸化脂質の測定には,質量分析装置が用いられているが,酸化リン脂質の構造情報を獲得するには,質量電荷比(m/z)値やフラグメンテーションパターンによる各分子のタンデム質量分析(MS/MS)パラメータが必要である.そこで,我々はこれら課題を解決するため,質量分析によるノンターゲット分析に着目した.本手法は,構造未知の化合物の同定に有用である.さらに,近年の高分解能質量分析計(HRMS)やデータ処理技術の発展により,膨大な数のMSMSピークを包括的にアノテーションすることが可能となっている.
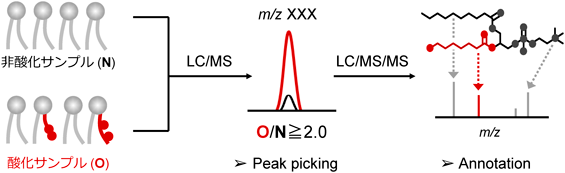
そこで我々は,まず,PC16:0/PUFAをAAPHまたはAAPH+heminで酸化し,試料から脂質を抽出した後,両方の抽出液を混合し,HPLCと高分解能質量分析計を組み合わせ(LC/HRMS)分析した59)(図10).そして,HRMSスペクトルの中からoxPCs由来のピークを選択するために,酸化(O)/非酸化(N)の強度比が2.0を超えるシグナルを選択した.その後,HRMS/MSスペクトルにPC基と二つの脂肪アシル基に由来する三つの典型的なプロダクトイオンを確認し,酸化リン脂質とした.その結果,リノール酸,アラキドン酸,ドコサヘキサエン酸の3種類のPC16:0/PUFAに由来する155種のoxPCsを同定した59).その中で,意外にも103種のoxPCは,これまでに報告のない新規のoxPCsであった.また,酸化型PC16:0/PUFAの構造情報をもとに,酸化型PC18:0/PUFAおよび酸化型PC18:1/PUFAの構造として,最終的に465種のoxPCsのMS/MSライブラリーを構築した.また興味深いことに,oxPCsの生成量および種類は,用いる刺激の種類によってかなり変動するようである.これまで,酸化剤が異なれば生成している酸化物の種類が違うことは想定されてはいた.今回の結果を踏まえても,用いる酸化剤や基質が異なれば,細胞や動物実験で結果が違うのは当然かもしれない.
2)疾患モデルでの酸化リン脂質の解析
先の脂質由来ラジカルの場合と同様に,動物モデルでも酸化リン脂質は検出できるだろうか? 解熱鎮痛薬であるアセトアミノフェンは,肝シトクロムP450 2E1(CYP2E1)の作用により代謝され,通常グルタチオン抱合系により無毒化される.しかし,過剰摂取により肝毒性を示す.最近の研究では,脂質過酸化物がアセトアミノフェン誘発性の肝細胞死に関与していることも報告されている60).
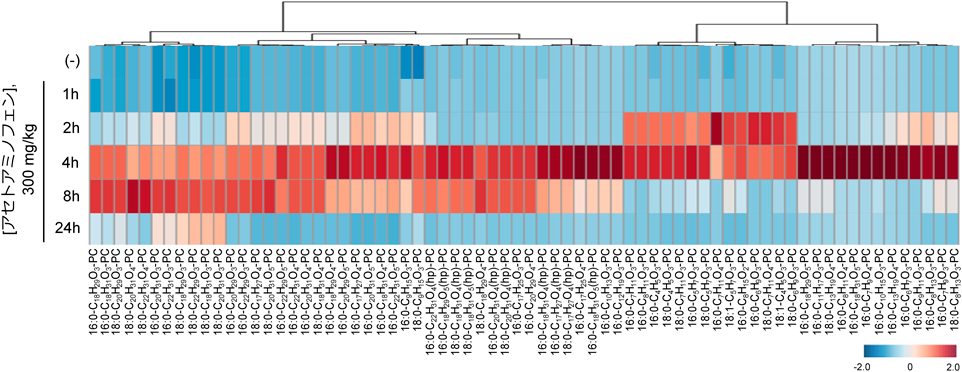
実際に,アセトアミノフェンを動物に投与すると,70種類のoxPCsが生成していることが,先の酸化リン脂質ライブラリーをもとに明らかになった59)(図11).また,このoxPCsは,酸化酵素の阻害剤投与により,顕著に減少した.興味深いことに,アセトアミノフェン投与後の時間によって,生成するoxPCsの種類および量が大きく変動していた.さらに,一部のoxPCsがALT値の増加前に上昇していることは,その後の肝細胞死に対するoxPCsの関連性を示唆している.
3)酸化リン脂質の質量イメージング
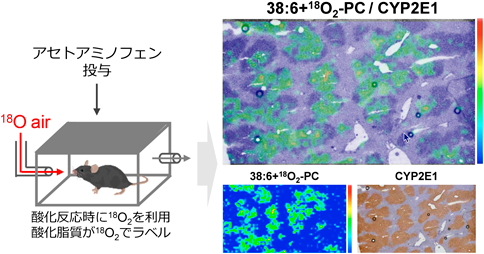
では,oxPCsは肝臓のどの部位で生成しているのであろうか? 近年,質量イメージング(MALDI-MS/MS/MSI)の開発や応用が精力的に進められている61–63).特に,酸化リン脂質のような低分子や,抗体を作製できないような分子の位置情報を明らかにするには,質量イメージングがきわめて有効であろう.MALDI-MS/MS/MSIではレーザーを利用するが,oxPCsの可視化を行う際,レーザー照射によりリン脂質が酸化されうることが判明した.これは,質量イメージングを行う上で重大な問題である.すなわち,酸化アーチファクトとしてのoxPCsか,本来生体内で生成したoxPCsかを区別できない可能性がある.しかし,酸化反応が生じている間18O含有空気(N2 79.5%,18O2 20%,CO2 0.5%)を利用すると,酸化反応時には18Oが利用され,レーザー照射による酸化アーチファクトとしての大気中16Oとは区別できる.実際にin vitroの実験で,18O標識により,MALDI-MS/MS/MSIによるoxPCsの検出および画像化の際に生じる酸化アーチファクトを除外できた59).
そこで,アセトアミノフェンを投与後,マウスを2時間18O2空気にさらした(図12).その結果,バックグラウンドノイズが少なく,内因性のoxPCの分布を可視化することに成功した.この生成量は,18O2空気吸入の時間によって変化した.また,生成部位は,アセトアミノフェンの代謝酵素であるCYP2E1が高発現している静脈領域,グルタチオンの枯渇部位とよく一致していた.
以上より,構築したoxPCsのHRMS/MSライブラリーとin-vivo 18Oラベル化により,アーチファクトとしてのバックグラウンドノイズを軽減し,oxPCsを選択的に可視化することが可能となったといえる.また実際に,疾患モデル動物の組織におけるoxPCs形成部位に関する重要な情報を提供することも可能となった.