微小管はαチューブリンとβチューブリンからなるヘテロ二量体が縦方向につながってできる13本の原繊維が横方向に集合することで形成される中空の細胞骨格である.βチューブリンに結合しているGTPはヘテロ二量体が微小管ポリマーに取り込まれた直後にGDPに加水分解されるため,微小管が重合する末端(プラス端)にのみ数分子のGTPチューブリンが残され,微小管本体のほとんどは管構造からはがれやすいGDPチューブリンから構成される.この特徴的なポリマー構造のため,特に微小管のプラス端は重合と脱重合が繰り返す,ダイナミックな動態を示す.チューブリンのアミノ酸配列は真核生物でよく保存されていることから,微小管の基本的な物理的特性は動植物でほぼ同じと考えられる.また,遊離チューブリンが細胞内で重合を開始するのに重要なγチューブリン含有環状複合体(γTuRC)も動植物でよく保存されている.
一方,動物細胞で主要な微小管重合中心である中心体(centrosome)は植物細胞に存在せず,植物の微小管は中心体の制約から解除された細胞内配置を示す.特に間期細胞では,ほとんどの微小管は細胞膜内側に張りついた表層微小管として存在し,セルロース合成酵素複合体が細胞膜上を移動する際のレールとして機能することにより,細胞の極性肥大に寄与する1).また,微小管動態,微小管どうしや微小管と細胞小器官との相互作用などを制御する種々の制御因子の一部は動植物間で保存されているものの,植物特有の微小管制御タンパク質も数多く発見されてきている.さらに,動物細胞で広範囲にみられるチューブリン翻訳後修飾は植物細胞では非常に限られている2).こうした微小管制御様式の多様化は動植物細胞に特有の細胞機能に大きく貢献していると考えられる.
本稿では,分子遺伝学,生化学,細胞生物学を用いた研究から明らかになってきた植物細胞での微小管機能を紹介したい.
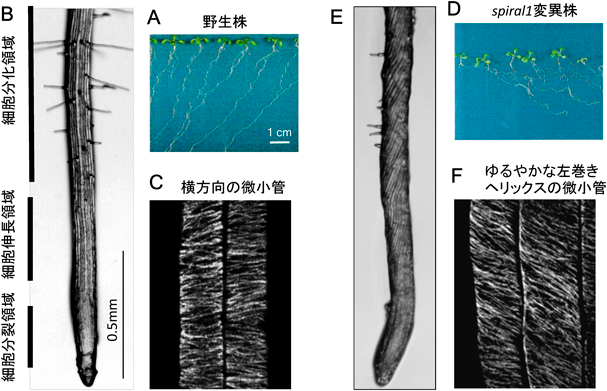
微小管と植物細胞の極性伸長との関連は,ねじれ変異株の解析から思いがけなく示唆された.モデル双子葉植物であるシロイヌナズナを固い寒天上で育てると,根は重力方向に向かって下方に伸びる.根の伸長方向が異常な変異株をスクリーニングすると,重力屈性が異常な変異株(培地上を無方向に伸長する)に加えて,培地上を常に斜め右または左方向に伸長する変異株集団が得られた(図1)3).これらの方向性を持つねじれ変異株では,根,暗所胚軸,葉柄などの伸長する軸組織の表皮細胞が右巻きまたは左巻きヘリックスをかたどるように配置されており,右巻きヘリックス表皮細胞を持つ根は培地上を左方向に,左巻き表皮細胞の根は右方向に伸びる.変異遺伝子を特定すると,大部分はチューブリンの優性機能獲得型点変異4, 5)であり(図2),残りはγTuRC構成タンパク質6),植物特有の機能未知タンパク質(後に微小管制御因子と判明7–11))であった.微小管脱重合薬剤を低濃度で野生型植物に投与するとねじれ表現型をミミックできることからも7),異常な微小管状態がねじれ伸長を引き起こしていることが明らかとなった.
右巻きヘリックス様にねじれている表皮細胞では,表層微小管束は左巻きヘリックスを形成しており,左巻き表皮細胞ではこの逆である.また,表層微小管の配向異常は細胞分裂が盛んな根メリステム領域ではみられず,細胞が伸長を始めた領域(まだ,細胞が傾く以前)から観察される.これらの観察結果は,微小管の配向異常が傾いた表皮細胞列を作り出ることを支持している.
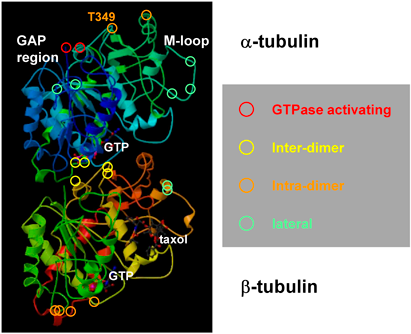
微小管の配向異常がねじれ伸長を引き起こすことは容易に想像できるが,なぜある種の微小管変異では右巻き表現型となり,他の場合は左巻きになるか,すなわち,表層微小管ヘリックスの左右性を決定している微小管要因とは何か,という疑問が生じる.数多くのチューブリン変異株はその変異箇所により,右巻きタイプと左巻きタイプに分類される4, 5).いくつかの変異(たとえば,αチューブリンのGTPase activatingアミノ酸残基の変異5))では,微小管がより安定化していることが判明しているが,安定性だけでは微小管ヘリックスの左右性の説明は困難である.
左右性の原因として,チューブリンや微小管制御因子の変異,あるいは低濃度の微小管薬剤が,微小管原繊維数が異常な微小管を部分的に形成する可能性が提唱されている12).微小管原繊維数はほとんどの細胞で13本に規定されているが,試験管内では13本以外の原繊維数を持つ微小管も作られる.特殊な細胞種や生物種では13本以外の原繊維数も観察されている13).13本という数は,細胞内でγTuRCによる微小管重合開始時と微小管端における制御タンパク質による校正機能により形成・維持されている.興味深いことに原繊維がまっすぐに並ぶのは野生型チューブリンから構成される13本の微小管のみであり,13本以外の原繊維から構成される微小管は原繊維がゆるやかに右または左巻きのヘリックス(super-helix)を描く14).原繊維がまっすぐに並ぶ微小管を持つように細胞が進化した理由は不明であるが,植物に限っていえば,軸組織をまっすぐに伸ばすのに(左右どちらにも傾かないように)必要ではないかと想像される.この仮説の実証には,種々の原繊維数を持つ微小管を基盤に張りつけて伸長させ,その伸長方向が左右にずれるかどうかを調べるin vitro再構築系の確立が必要である.
つる性植物では,つるが傾く方向は植物種により遺伝的に決まっている.たとえば,アサガオのつるは右巻きであり,オニドコロのつるは左巻きである.植物界全体でみれば,右巻きのつる植物種が大勢を占めるが15),シロイヌナズナのねじれ変異株も右巻きが大部分であることは興味深い.
ちなみに,植物ホルモンであるオーキシン輸送体16)とその制御因子17, 18)の変異にも根などがねじれて伸長するものがある.しかし,これらの変異株はねじれる方向が決まっておらず,同一変異でも右にねじれたり,左にねじれたりする.おそらく,軸組織の内部細胞と表皮細胞の伸長速度の同調がうまくゆかずにねじれるが,左右性情報が欠如しているために,表皮細胞がランダム方向に傾くものと考えられる.
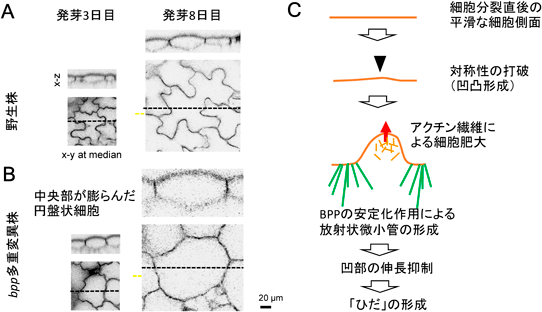
上記の軸組織を構成する細長い細胞形状以外にも,表層微小管は種々の複雑な植物細胞の形状を形作るのに必須である.好例として,葉のジグソーパズル様の表皮細胞があげられる.分裂直後の表皮細胞のまっすぐな側面にわずかなゆがみが生じ,その凸部分がアクチン繊維の働きによる細胞膜新生作用により伸長する一方,凹部分の膨張が抑えられることにより,凹凸が顕著な細胞へと分化してゆく(図3).この過程で,初期の細胞側面のゆがみ形成(対称性の崩れ)とそれ以降の凹凸拡大では異なる分子機構が働いていることが知られている19).対称性の崩れが観察される初期段階においても特徴的な微小管束が該当細胞箇所に観察され,微小管の関与が提唱されているが20),ペクチン微繊維に由来する細胞壁の物性の不均一性も報告されている21).一方,凹部の膨張抑制には凹部から放射状に広がる微小管(radial microtubule array)が必須である.この微小管が特異的に形成されない微小管安定化タンパク質BPP(basic proline-rich proteins)の多重変異株では,初期段階のわずかな細胞側面のゆがみを保ったまま,細胞側面全体が肥大するため,ほぼ円盤状の葉表皮細胞へと成熟する22).
近年,細胞局所に働く機械的ストレス方向に平行に表層微小管が並ぶ現象が多く報告されている.その分子機構は不明であるが,一定方向に並んだ微小管がセルロース微繊維の配向を介して細胞壁を局所的に補強し,細胞形状の形成を促進する一方,作られた細胞形状が微小管の並び方を規定するという正のフィードバック制御がかかると考えられる23).上記のBPP変異株22)では,凹部分となるべき場所に放射状微小管が形成されずに凹部分が成長せず,この箇所に局所的な機械的ストレスがかからない.野生型のジグソーパズル様細胞ではいくつかの凹部に細胞膨圧に起因する機械ストレスが分散されるが,変異株細胞では機械的ストレスは細胞中央部分に集中し,円盤状の細胞の中央部分が顕著に膨らむ.ジグソーパズル様形状の生物学的意義の一つとして,表皮細胞の表面がフラットとなり,なめらかで平坦な葉表面を作ることがあげられる.
4. 細胞表層に分散した微小管形成と微小管パターン形成
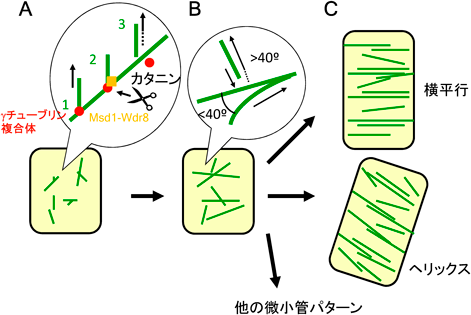
多くの動物細胞では細胞内部の核膜近傍に位置する中心体から微小管が誕生し,細胞表層に向かって内から外に伸びてゆく.間期植物細胞では,細胞表層の微小管側面にγTuRCが張りつき,枝分かれ状または既存微小管に平行に新規娘微小管が誕生する24).新規微小管を重合させたγTuRCにはしばらくすると細胞切断タンパク質複合体酵素カタニン(katanin)がリクルートされ,娘微小管は母親微小管の側面から切り離されて,遊離微小管となって細胞膜内側に張りつきながら重合・脱重合を繰り返し移動してゆく(図4)24).移動する微小管どうしは頻繁に衝突し,束化や消失を繰り返しながら,微小管集団として特定のパターンを形成する1).
シロイヌナズナ培養細胞から微小管付随タンパク質(microtubule associated proteins:MAPs)を網羅的に精製したところ,上記の植物特異的ファミリータンパク質BPPなど,多くの機能未知タンパク質が同定された25).これらMAPsを蛍光タンパク質で標識し,植物細胞で発現させると多くは微小管に沿って局在したが,分裂酵母のmitotic spindle disanchored 1(Msd1;動物ではSSX2IPとも呼ばれる)と動物のWD40-repeat protein 8(Wdr8)の植物ホモログは,表層微小管上にドット状で局在することが判明した25).両タンパク質はヘテロ二量体を形成し,分裂酵母ではspindle pole bodyに,動物細胞では中心体に,γTuRCから重合した微小管のマイナス端をつなぎとめている.植物細胞においても,Msd1–Wdr8複合体は表層微小管上のγTuRCから重合した娘微小管を母親微小管につなぎとめる「のり」の役割を担っていた26).興味深いことに,植物細胞ではこの複合体はカタニンがリクルートされる目印となっており,野生型細胞では「はさみ」(カタニン)が呼び寄せられるまで,娘微小管は母親微小管上に安定に維持される26).Msd1–Wdr8複合体の変異細胞では,カタニンは機能せず,娘微小管を重合したγTuRCが母親微小管上に安定に保持されないため,娘微小管は重合箇所から結局自然にはがれていく.Msd1–Wdr8複合体の有無にかかわらず,娘微小管は切り離されるが,この複合体は切り離しのタイミングをカタニン活性の厳密な依存下に置くことで,細胞内外からのシグナルに応じて植物細胞での微小管パターンを制御することを可能にしたと考えられる.植物細胞が進化の過程で従来からの微小管制御因子に新たな植物特有の制御機能をつけ加えた好例である.
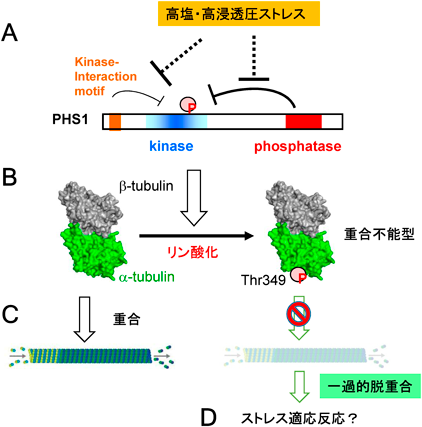
表層微小管がセルロース微繊維の配向を介して細胞の形を決める分子機構(極性伸長)が精力的に研究されてきたが,植物細胞が置かれる外界環境の変化に微小管が迅速に応答することが最近明らかになってきた.我々がスクリーニングしたねじれ変異株の一つpropyzamide-hypersensitive 1(phs1-1d)がその発端となる27).phs1-1dはmitogen-activated protein kinase(MPK)phosphatase様タンパク質の優性変異株であり,右巻きねじれ表現型を示すとともに,低濃度の微小管脱重合薬剤propyzamideに対して高感受性である.この優性変異株では哺乳類のMPK phosphataseのkinase interaction motif(KIM)として同定されている重要なアミノ酸残基の点置換変異が起こっていた.さらなる解析により,N末端のKIMとC末端のphosphataseに挟まれた中央部分に粘菌のactin-fragmin kinaseのkinase相同領域があり,PHS1ではアクチンではなくαチューブリンのトレオニン349(T349)を特異的にリン酸化することが判明した(図5)28).T349はチューブリン二量体が重合する際に,微小管原繊維の縦方向の相互作用に決定的な役割を果たし,この部位がリン酸化されたチューブリンは重合活性がほとんど失われていた.また,ねじれ変異株にはT349がイソロイシンに変化した変異株も見つかっており5),微小管が不安定な右巻き変異形質を示す.
in vitroにおいてPHS1のチューブリンリン酸化酵素は野生型酵素では不活性に保持されている.この不活性化には,KIMとPHS1 phosphataseの両方が直接的に,かつ独立に働いており,phosphataseはチューブリンリン酸化酵素の活性化に重要なリン酸基を除去することにより活性抑制作用を持つと考えられる(未発表).また,KIMとPHS1 phosphatase領域はMPK phosphataseを起源に進化したものと推測されるが,PHS1の活性化制御にはMPKは必須ではない(未発表).
非ストレス下での植物細胞においてもPHS1のチューブリンリン酸化酵素は野生型酵素では不活性であり,細胞内のチューブリンのT349はほとんどリン酸化されていない.しかし,乾燥ストレスや高塩条件が引き起こす高浸透圧ストレスは即座にPHS1を活性化させ,チューブリンT349のリン酸化と表層微小管の脱重合を引き起こす.このチューブリンのリン酸化と微小管脱重合は一過的であり,30分から1時間程度をピークにその後すばやく通常状態に戻る.phs1-1d変異株ではKIMによるチューブリンリン酸化活性抑制が十分に機能しておらず,非ストレス状態でもある程度のT349リン酸化と微小管の不安定化がみられる.
PHS1によるストレスに応答した迅速で一過的な微小管脱重合はどのような生物的な意義を持つのであろうか? シロイヌナズナのPHS1破壊株は環境ストレスの有無にかかわらず,実験室では野生株と異なる生育や分化を示さない.ゲノム解読された顕花陸上植物ではすべてPHS1遺伝子が保存されていることから,何らかの乾燥ストレス応答に関わっていることが示唆されるが,陸上植物で高度に進化したアブシジン酸(ストレスホルモン)の働きにより,微小管依存的なストレス応答がみえにくくなっている可能性がある.淡水性緑藻クラミドモナスでもPHS1による高浸透圧ストレス応答性微小管脱重合反応は保存されているが,いくつかの海洋性緑藻ゲノムにはPHS1遺伝子が欠損している29).微小管を介した新規の乾燥ストレス応答は従来のアブシジン酸シグナル伝達経路を補完するものとして,今後の研究の進展に期待したい.
植物細胞は移動能力を持たず,強固な細胞壁で周囲を覆うように進化した.その過程で,中心体のような細胞内部に集約された微小管重合中心を作るのではなく,細胞膜内側に微小管を形成し,その表層微小管を介して細胞壁にセルロース微繊維を配置する分子機構を発達させた.液胞に由来する大きな細胞膨圧はすべての細胞表面に均等にかかるが,セルロース微繊維の配向を局所的に制御することにより,極性を持つ細胞伸長様式を作り出すことが可能になり,この制御には表層微小管のパターン形成が必須である.表層微小管の存在様式は一部動物と共通の制御因子を用いているが,共通因子に別機能を付与したり,植物特有の制御を進化させている.
興味深いことに,植物細胞では環境ストレス(乾燥や塩害がもたらす高浸透圧)により表層微小管がすばやく,一過的に消失する.この反応を担うPHS1キナーゼ遺伝子は淡水性藻類で進化し,陸上植物で保存されているが,細胞骨格がストレス応答や適応反応にどのように貢献しているかはほとんどわかっていない.セルロース合成以外に表層微小管が果たす生理的な意義はどのようなものであろうか? 細胞骨格を介した環境応答シグナル伝達経路が将来,解明されることを期待する.