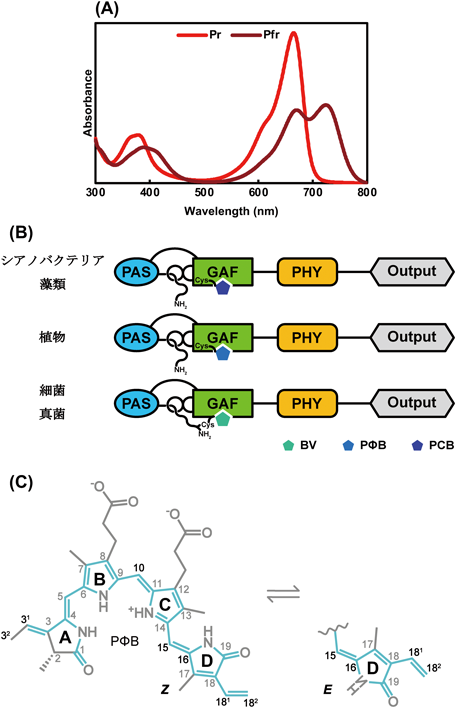
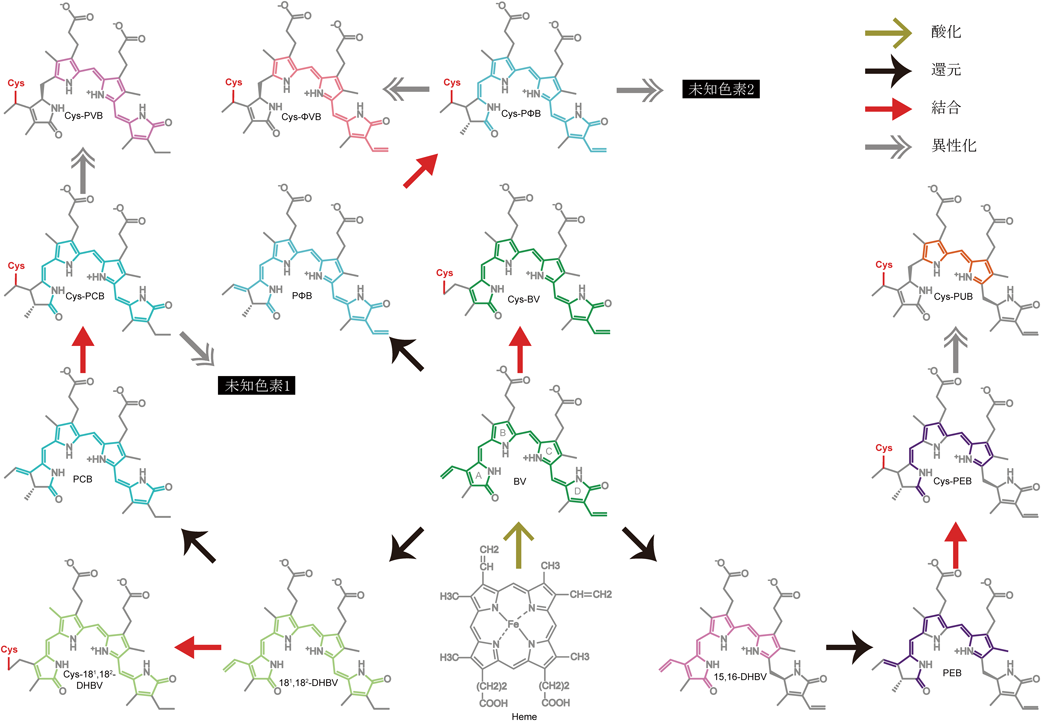
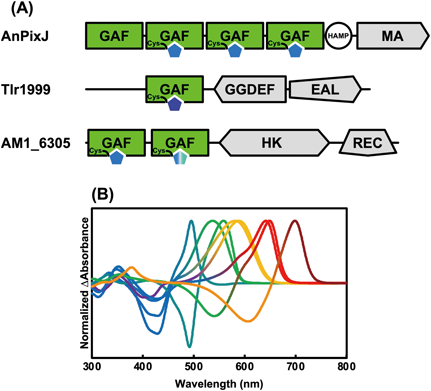
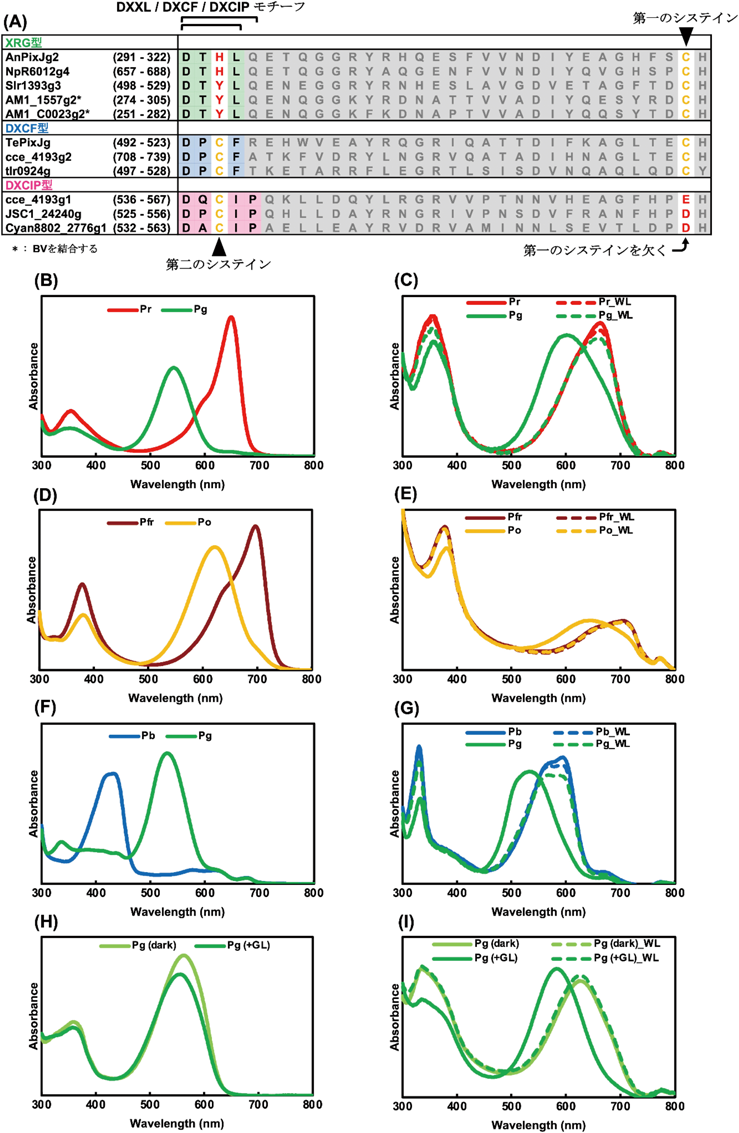
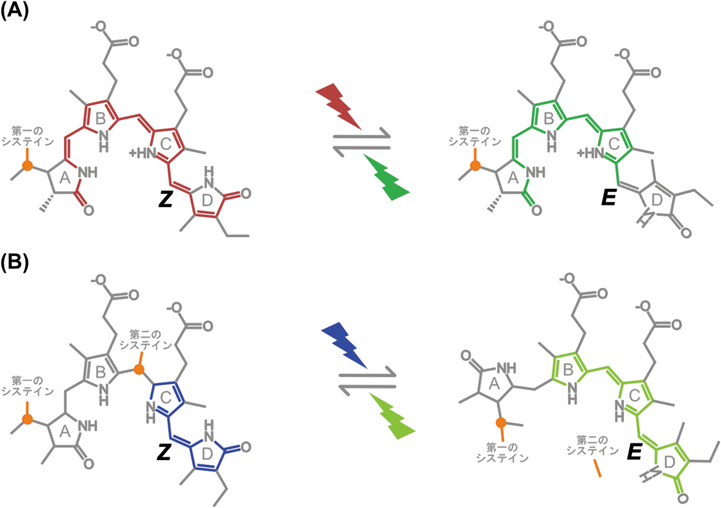
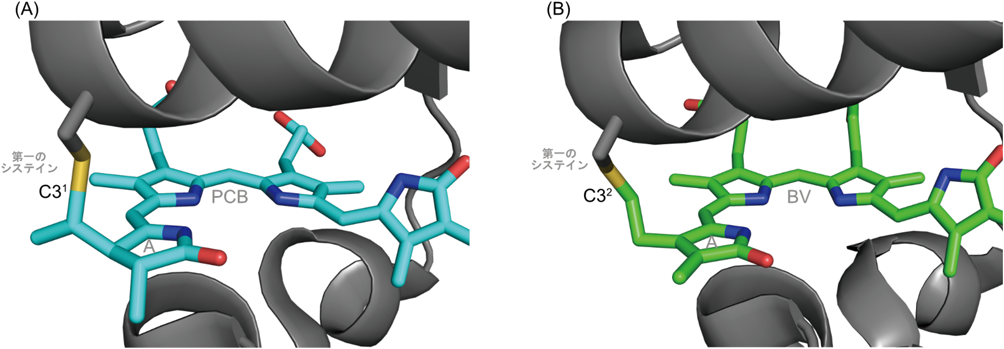
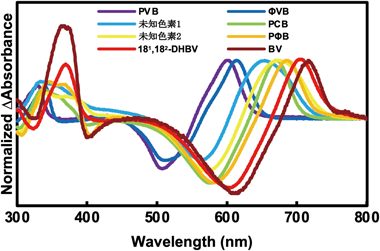
シアノバクテリオクロムの結合色素多様性Diversity of binding chromophore species of the cyanobacteriochrome photoreceptors
1 東京都立大学大学院理学研究科生命科学専攻Graduate School of Biological Sciences, Faculty of Science, Tokyo Metropolitan University ◇ 〒192–0397 東京都八王子市南大沢1–1 ◇ 1–1 Minami-Ohsawa, Hachioji, Tokyo 192–0397, Japan
2 静岡大学大学院自然科学教育部バイオサイエンス専攻Graduate School of Science and Technology, Shizuoka University ◇ 〒422–8529 静岡県静岡市駿河区大谷836 ◇ 836 Ohya, Suruga, Shizuoka 422–8529, Japan