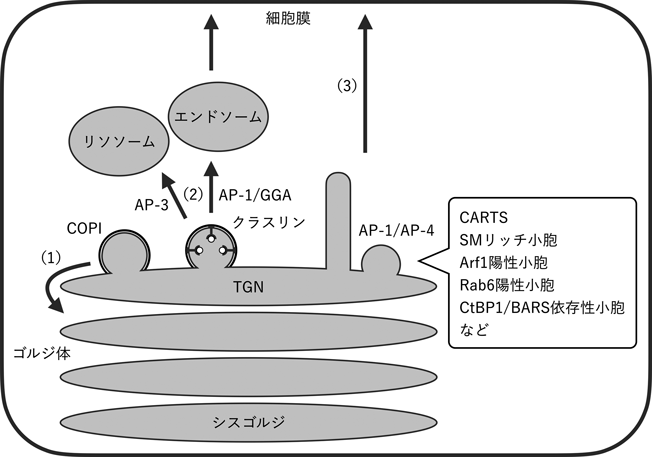
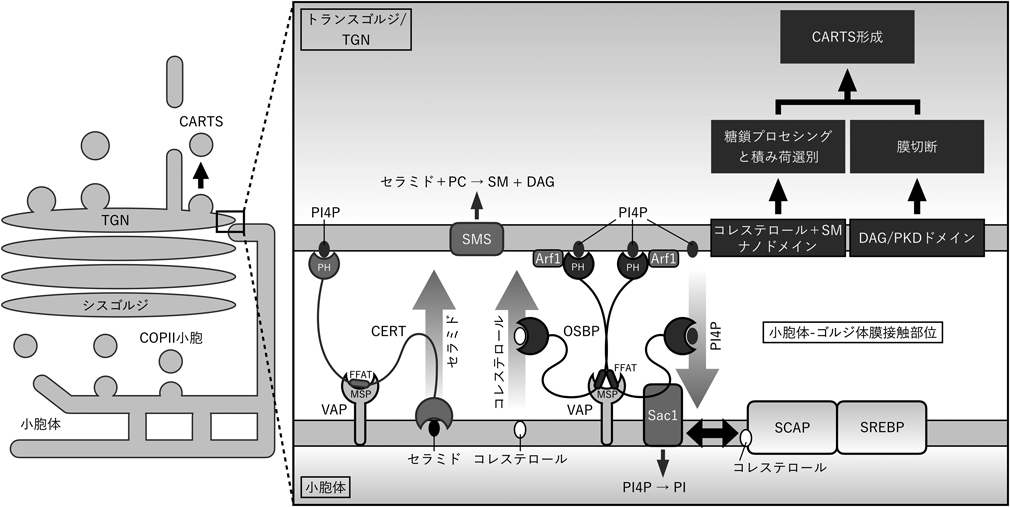
小胞体–ゴルジ体膜接触を介したトランスゴルジネットワークからのCARTS輸送小胞形成の制御Regulation of CARTS biogenesis from the trans-Golgi network through ER–Golgi membrane contact sites
東京薬科大学生命科学部Tokyo University of Pharmacy and Life Sciences ◇ 〒192–0392 東京都八王子市堀之内1432–1 ◇ 1432–1 Horinouchi, Hachioji, Tokyo 192–0392, Japan