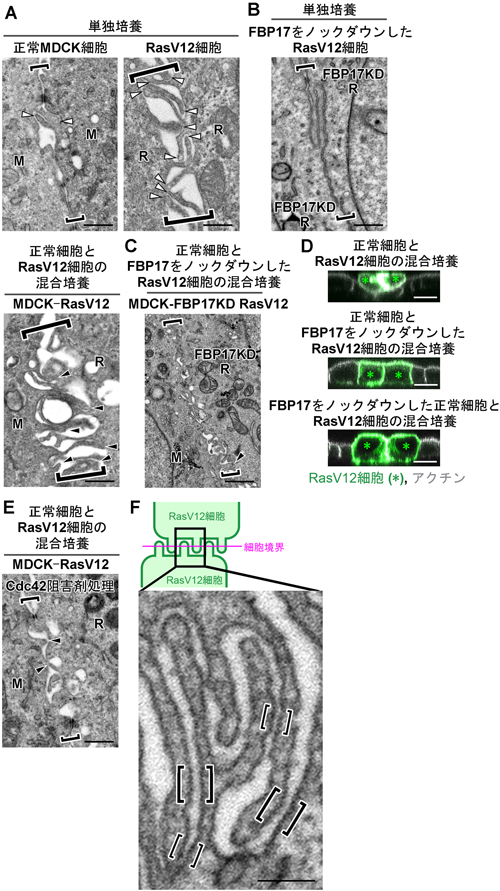
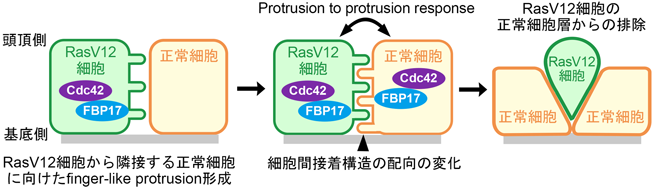
正常細胞と変異細胞の境界における細胞突起を介した相互認識メカニズムIntercellular recognition mediated by finger-like protrusions between normal and Ras-transformed cells
北海道大学医学研究院細胞生理学教室Department of Cell Physiology, Graduate School of Medicine, Hokkaido University ◇ 〒060–8638 北海道札幌市北区北15条西7丁目 ◇ North 15, West 7, Kita-ku, Sapporo, Hokkaido 060–8638, Japan