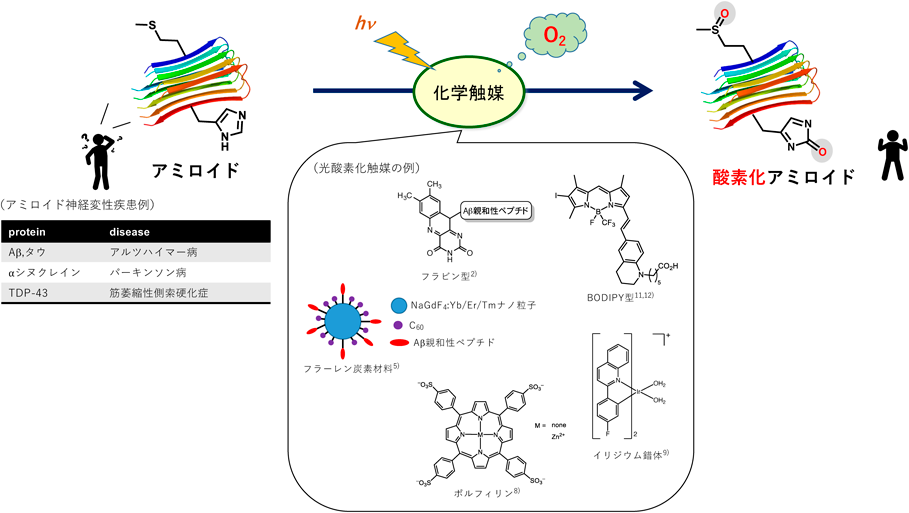
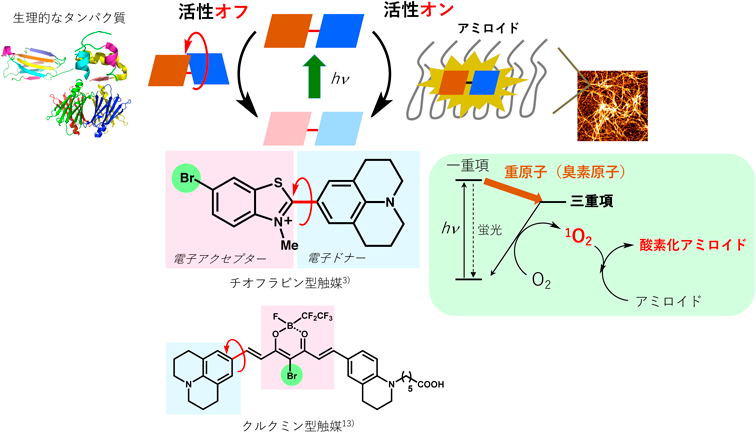
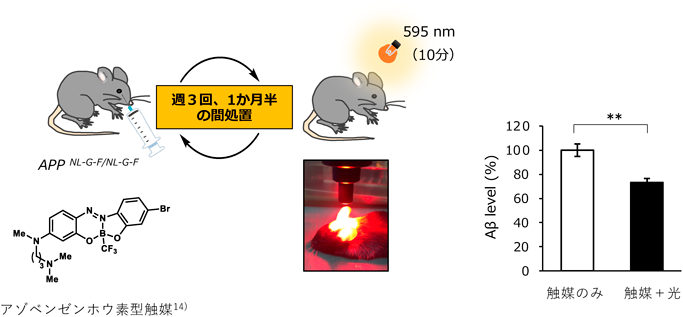
化学触媒を用いた光酸素化反応による神経変性疾患の治療を目指してTherapeutic strategy for neurodegenerative diseases by photooxygenation reaction using chemical catalysts
1 和歌山県立医科大学薬学部School of Pharmaceutical Sciences, Wakayama Medical University ◇ 〒640–8156 和歌山県和歌山市七番丁25–1 ◇ 25–1, Shichibancho, Wakayama 640–8156, Japan
2 東京大学大学院薬学系研究科Graduate School of Pharmaceutical Sciences, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 ◇ 7–3–1, Hongo, Bunkyo-ku, Tokyo 113–0033, Japan