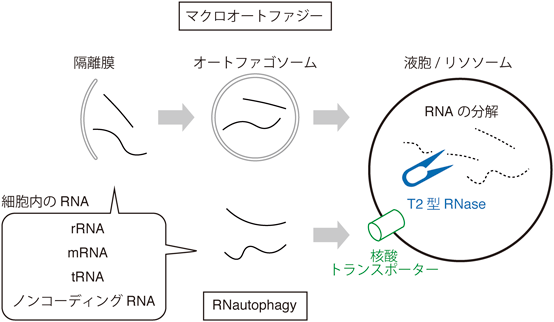
生物を構成するタンパク質,脂質,核酸は環境の変化に応じて合成・分解され,その量は適切に調節されている.オートファジーは自己の細胞内成分を液胞(出芽酵母・植物)/リソソーム(動物)に輸送し分解する機構であり,哺乳動物にまで高度に保存されている.オートファジーにはマクロオートファジーやミクロオートファジー,膜透過型オートファジーなどさまざまな経路がある.主な経路であるマクロオートファジーでは,細胞内成分はオートファゴソームという脂質二重膜に取り囲まれて液胞に運ばれた後,液胞内の酵素により分解され,さまざまな形で再利用される.
オートファジーはこれまで主にオルガネラやタンパク質の分解系として解析が進められてきたため,細胞内にはさまざまな種類のRNAが存在するにもかかわらず,オートファジーによるRNA分解の理解は遅れている.近年,オートファジーがRNAの分解に寄与することが明らかになってきた.しかし,どのような特徴を持つRNAがオートファジーで分解されているのか,選択性の有無や生物学的意義はわかっていなかった.本稿では,オートファジーを介したRNA分解に関する最新の知見を概説し,最近筆者らが見いだしたmessenger RNA(mRNA)分解の選択性1)について紹介する.
30年以上前に,飢餓状態のヒト線維芽細胞やアミノ酸飢餓時のラットの肝臓において,オートファジーによってRNAが分解されることが示唆された2, 3).それ以来,長年オートファジーによるRNA分解の責任酵素は同定されていなかったが,近年その分解活性を担うのは高等真核生物にまで高度に保存された液胞内T2型RNaseであることが出芽酵母や植物,線虫でわかってきた4–6).出芽酵母では,オートファジーで液胞に運ばれたRNAは,液胞内T2型RNaseであるRny1によってヌクレオチドとなり,さらに塩基にまで分解されるという一連の過程が見いだされた5).また,ヒト培養細胞とマウスにおいては,膜透過型オートファジーの一種として,核酸トランスポーターを介して直接RNAがリソソームに取り込まれるRNautophagyが報告された7).このように,細胞内のRNAは複数の経路でオートファジーによって分解されることがわかってきた(図1).
オートファジーは非選択的な分解系と考えられてきたが,近年の研究により,アダプタータンパク質を介して特異的な基質やオルガネラを分解する選択的オートファジーの存在も明らかになってきている.細胞内には多様なRNAが存在していることから,オートファジーによるRNAの分解に選択性はあるのか,という疑問が生じる.
窒素源飢餓を模倣したラパマイシン処理によるオートファジー誘導条件下でrny1欠損変異株とrny1atg2二重欠損変異(オートファジー不能)株から液胞を単離すると,オートファジー依存的に液胞内にRNAが蓄積していた.出芽酵母でRNautophagyの経路は見つかっていないが,Atg2はオートファゴソームの形成に必須な因子であることから,RNautophagyに依存せず液胞内に運ばれたRNAであるといえる.
そこで筆者らは,Rny1欠損変異株の液胞に分解されずに蓄積したRNAを網羅的に解析することで,オートファジーによって分解されるRNAの選択性を明らかにできるのではないかと考えた.特にmRNAに着目してその分解の選択性を調べた.ラパマイシン処理条件下でrny1欠損変異株から液胞を単離し,蓄積しているmRNAをRNA-seqにより網羅的に解析した.その結果,オートファジーによって液胞内に運ばれるmRNAには運ばれやすいmRNAと,運ばれにくいmRNAがあることがわかった.よって,オートファジーによるmRNA分解はランダムではなく選択性があるということが強く示唆された.
遺伝子オントロジー解析の結果,分解されやすいmRNAにはアミノ酸生合成に関わる一群の遺伝子やリボソームタンパク質をコードする遺伝子が含まれていることがわかった.それらの細胞内のmRNAは20~40%がオートファジーによる分解を受けていると実際に見積もられ,4-チオウラシルを用いたラベル実験によって細胞全体のRNA分解への寄与も確かめられた.この結果から,合成されるアミノ酸量やリボソーム量の調節に働いている可能性が考えられた.
分解されやすいmRNAはオルガネラなどとともに液胞に運ばれているのか手がかりを得るために,近年オートファジーによって選択的に分解されることが報告された小胞体や細胞質のRNP(ribonucleoprotein)顆粒の一つであるStress granuleに着目した.しかし,Stress granuleに局在もしくは小胞体膜に結合するmRNAは,分解されやすいmRNA群に特に多く含まれるわけではなかった.したがって,分解されやすいmRNAは小胞体やStress granuleの選択的な分解には依存せず液胞に運ばれていることが示唆された.
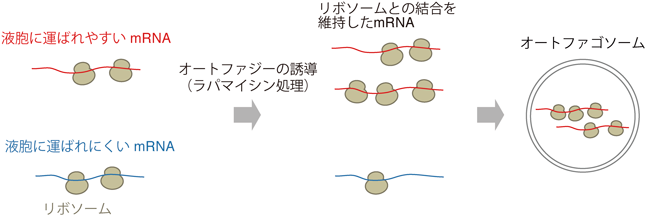
次に,過去の電子顕微鏡解析でオートファジーを誘導すると多量のリボソームがオートファゴソームに取り囲まれるようすが観察されることから8),リボソームと結合したmRNAが液胞に運ばれる可能性を考えた.分解されやすい代表的なmRNAのレポーター遺伝子を用いて,液胞へのmRNAの輸送と翻訳との関係性を調べた.開始コドンの直前にステムループ構造を挿入し翻訳を阻害したmRNAは液胞内に運ばれにくくなることから,翻訳が始まりリボソームが結合しているmRNAがオートファジーによって分解されやすいことが明らかとなった.さらに,分解されやすい代表的なmRNAの5′末端非翻訳領域を,分解されにくいmRNAの同領域に置換すると液胞への蓄積量は顕著に低下した.このことは,オートファジーによるmRNA分解の選択性は,5′末端非翻訳領域で決められる翻訳時のリボソームとの結合の親和性に依存することを示唆している.
さらに,翻訳との関係の詳細を明らかにするために,mRNAと翻訳中のリボソームとの結合を網羅的に解析する手法であるリボソームプロファイリング法で解析した.興味深いことに,分解されやすいmRNAはラパマイシン処理後にリボソームとの結合が維持される傾向があることがわかった.一方で,分解されにくいmRNAはラパマイシン処理時間が進むにつれてやや低下する傾向がみられた.定常時にリボソームとよく結合しているmRNAが必ずしも分解されるわけではなく,ラパマイシン処理によるオートファジー誘導後のリボソームとの結合の変化が分解されやすさを決める要因の一つのようである.また,なぜ液胞に運ばれやすいmRNAがラパマイシン処理後にリボソームとの結合を維持しているかは現在のところ未解明であり,今後の解析が待たれる.
以上の結果より,オートファジーによるmRNA分解はランダムではなく選択性があり,mRNA量の調節に寄与することが明らかとなった.オートファジーはタンパク質やオルガネラの分解機構として機能するだけでなく,一部のmRNAを優先的に分解することで遺伝子の発現を緻密に制御していると考えられる(図2).
このようにオートファジーによるmRNA分解には選択性があることがわかったが,一部のmRNAが優先的にオートファジーマシナリーによって認識されるメカニズムは未解明であり,どのように認識されているか,その実態は謎に包まれている.mRNAはポリソーム(リボソーム-mRNAの複合体)の状態で分解されていることが示唆されたため,過去に出芽酵母で報告された選択的なリボソームの分解機構であるリボファジー9)が関わる可能性が考えられた.出芽酵母において,細胞質の一般的なタンパク質との分解程度の比較から,リボソームタンパク質の方がより分解されていることをKraftらが見いだし,リボファジーと名づけられた.また,それに関わる因子として脱ユビキチン化酵素複合体Ubp3/Bre5が同定された.しかし,これらの因子の欠損株では依然としてリボソーム(rRNA)5)や筆者らが同定した分解されやすいmRNAの液胞内蓄積量にほとんど影響がないため(未発表),Kraftらにより定義されたリボファジーとは異なる機構でmRNAは分解されていると考えている.分解されやすさを決めるメカニズムとして,1)選択的オートファジーで観察されるようなアダプタータンパク質との相互作用,あるいは2)特異的な一過性のタンパク質もしくはRNAの修飾,3)分解されやすいmRNAの細胞質における一過的な存在状態がオートファジーマシナリーを呼び込む目印となっているのかもしれない.いずれにせよ,細胞質のポリソームの状態は一様ではなく,ストレス等の状態に応じて動的に変化していることを示唆している.分解されやすいリボソーム-mRNAと特異的に相互作用する因子の同定やmRNAの動態制御の解析から,認識機構の詳細が今後明らかになることが期待される.
オートファジーを誘導したストレス状態では,エネルギー負荷の大きいタンパク質合成は翻訳開始の段階で抑制されることが知られている.それに加え,ストレスに応答するためにラパマイシン処理後にリボソームとの結合を維持している一部のmRNAをオートファジーで分解することで,mRNA量とそのmRNAの翻訳の抑制という複雑なバランスを調節している可能性がある.
細胞は栄養飢餓などによる環境の変化に応答して,転写や翻訳の活性を巧みに調節し,遺伝子の発現を制御している.栄養飢餓時の転写制御や細胞全体の翻訳抑制メカニズムについては,世界中で急速に研究が進展してきた.それらに加え,筆者らの研究によって,オートファジーは転写後の段階でmRNA分解機構の一つとして働くことが明らかとなった.オートファジーがmRNAの分解を通じて遺伝子発現の恒常性維持に重要な役割を果たしていると考えられる.
本稿で紹介した筆者らの解析は,窒素源飢餓を模倣したラパマイシン処理条件における結果である.今後,他のオートファジー誘導条件である窒素源や硫黄源等の栄養飢餓での分解の選択性を調べることで,分解されやすいmRNA分解の一般性や飢餓特異的に分解されるmRNAの同定およびその特徴などが明らかになることが期待される.生理条件に応じてオートファジーによってmRNAが分解される機能的な意義の理解につながると考えられる.
出芽酵母でmRNAに関して選択性があることが今回新たにわかってきたが,その後植物において液胞内に含まれるRNAの網羅的解析から,葉緑体ゲノム由来の光合成関連の遺伝子をコードするmRNAやmicroRNA(miRNA)の一部がオートファジー依存的に分解されやすいことが報告された10).また,はじめに述べたRNautophagyではRNAの持つpoly-G配列が核酸トランスポーターとの結合に重要であることがわかってきた11).近年,ヒトゲノムの約4割を占めるレトロトランスポゾンのRNAをオートファジーが特異的に分解することで,ゲノムの安定性の維持に寄与することが報告された12).一方で,細胞内RNAのうち15%を占める翻訳に必須なtransfer RNA(tRNA)やその他の種々のノンコーディングRNAを分解しうるのか,選択性の有無も含め分解の詳細は不明である.オートファジーによるtRNAの分解が翻訳に影響を及ぼしうるかは興味深い課題である.オートファジーでどのように分解されているのか,経路や選択性がわかると,オートファジーを介したさまざまなRNAの分解の全体像がみえてくるだろう.
近年,ヒトの白質脳症の患者ではT2型RNaseであるRNASET2遺伝子が機能欠失していることや13),RNASET2遺伝子に変異のあるゼブラフィッシュでは脳の神経細胞内のリソソーム内にrRNAが分解されずに蓄積し,白質脳症に似た病変を示すことが報告されている14).このように,T2型RNaseのRNA分解活性は生物の高次機能に重要であることが示唆されている.しかし,細胞内の全RNAのうち80%を占めるrRNAに加え,非選択的もしくは選択的にリソソームに運ばれた種々のRNAが分解されずに蓄積することと疾患との関係は不明である.また,RNAの蓄積により間接的にリソソーム内のタンパク質分解に影響を及ぼす可能性も考えられる.
出芽酵母におけるオートファジー遺伝子が同定されて約30年,選択的なRNA分解というオートファジーの新たな機能的側面が少しずつ明らかになってきた.高等生物でのオートファジーを介したRNA分解の選択性やメカニズム,生物種間の普遍性を調べることで,RNAを分解する生理的な意義が明らかになることを期待したい.