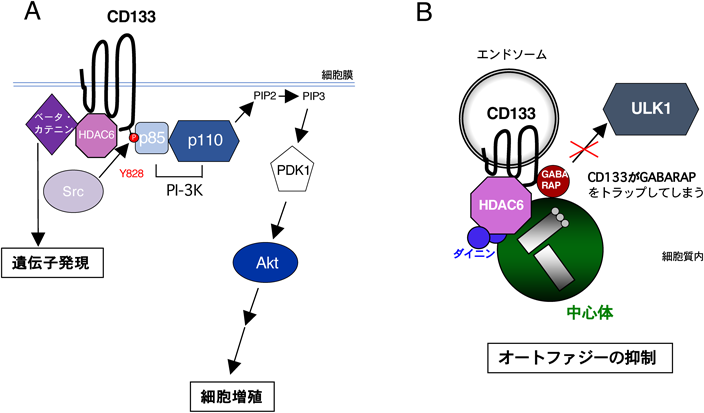
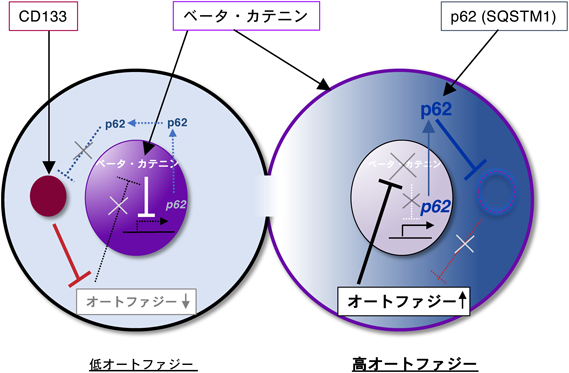
がん幹細胞マーカーCD133によるオートファジー制御と非対称分裂機構Regulation of autophagy and asymmetric cell division by the stem cell marker CD133
1 佐賀県医療センター好生館総合臨床研究所Medical Research Institute, Saga Medical Center KOSEIKAN ◇ 〒840–8571 佐賀市嘉瀬町中原400 ◇ 400 Nakabaru, Kase, Saga 840–8571, Japan
2 埼玉県立がんセンター臨床腫瘍研究所Saitama Prefectural Cancer Center ◇ 〒362–0806 埼玉県北足立郡伊奈町大字小室780 ◇ 780 Oaza Komuro, Ina-machi, Kitaadachi-gun, Saitama 362–0806, Japan
3 サガハイマットSaga HIMAT ◇ 〒841–0071 佐賀県鳥栖市原古賀町3049 ◇ 3049 Harakoga-machi, Tosu-shi, Saga 841–0071, Japan