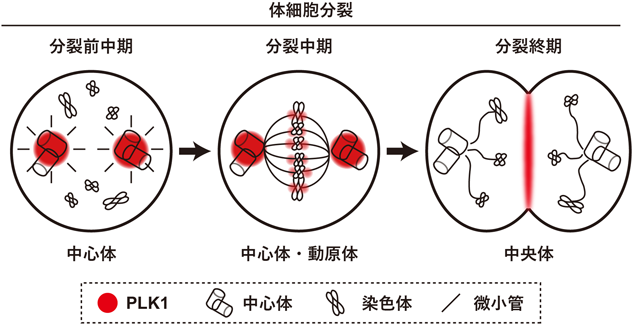
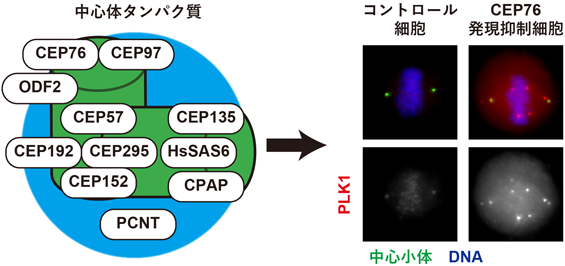
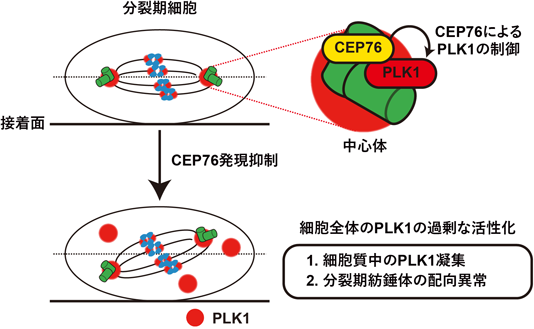
中心体タンパク質による分裂期PLK1制御を介した適切な細胞分裂保証メカニズムCEP76 regulates mitotic PLK1 and ensures proper mitotic progression
東京大学大学院薬学系研究科生理化学教室Laboratory of Physiological Chemistry, Graduate School of Pharmaceutical Sciences, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 ◇ 7–3–1 Hongo, Bunkyo, Tokyo 113–0033, Japan