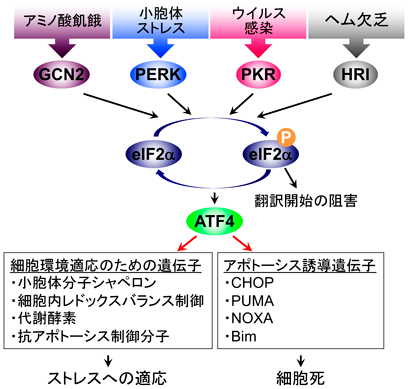
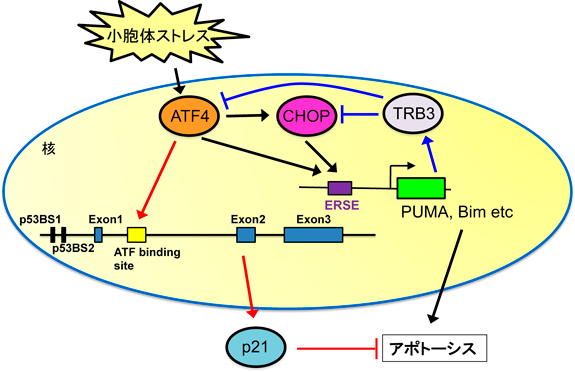
統合的ストレス応答の異常に起因した疾患における治療薬開発Development of therapeutic agents for diseases caused by abnormal integrative stress response
名古屋市立大学大学院薬学研究科細胞情報学分野Department of Cell Signaling, Graduate School of Pharmaceutical Sciences, Nagoya City University ◇ 〒467–8603 愛知県名古屋市瑞穂区田辺通3–1 ◇ Tanabe-dori 3–1, Mizuho-ku, Nagoya, Aichi 467–8603, Japan