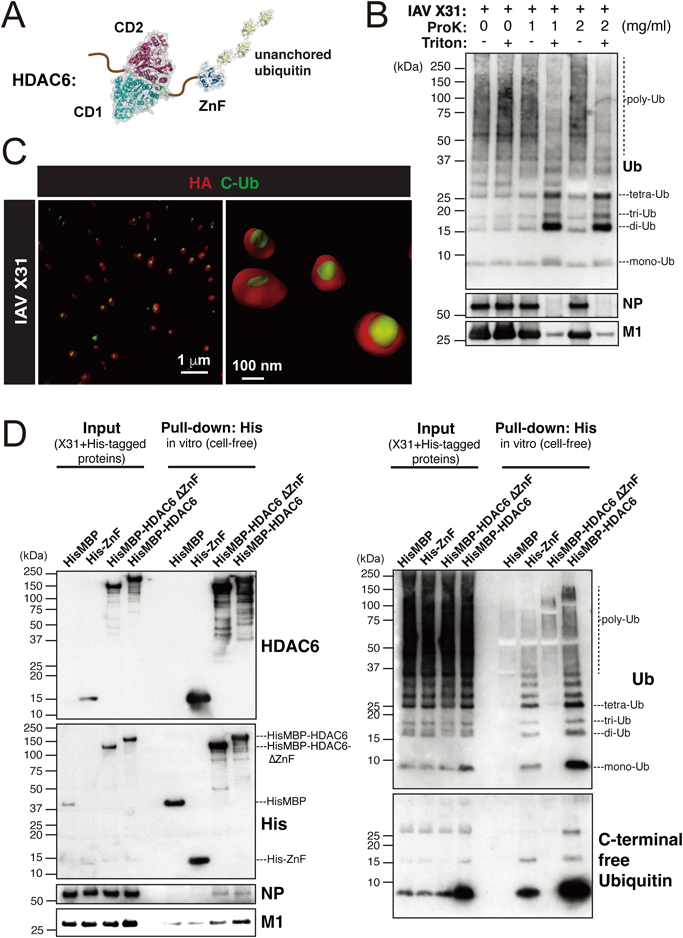
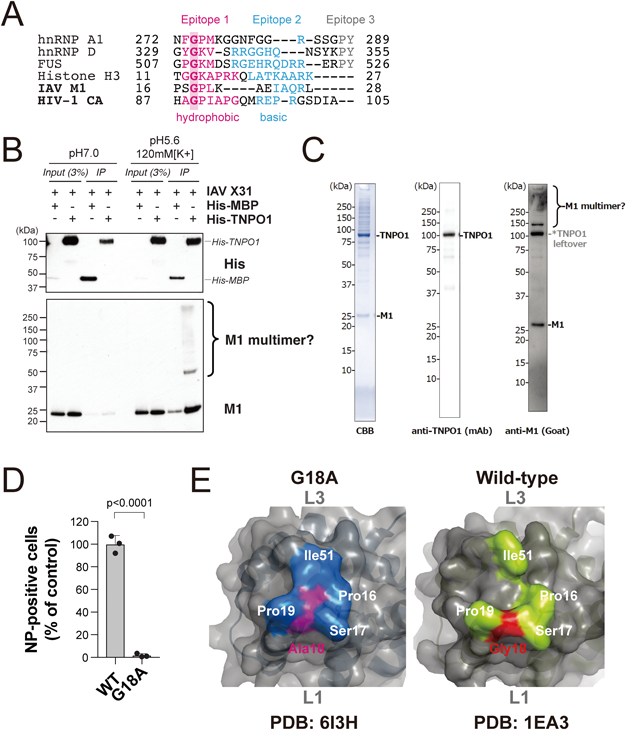
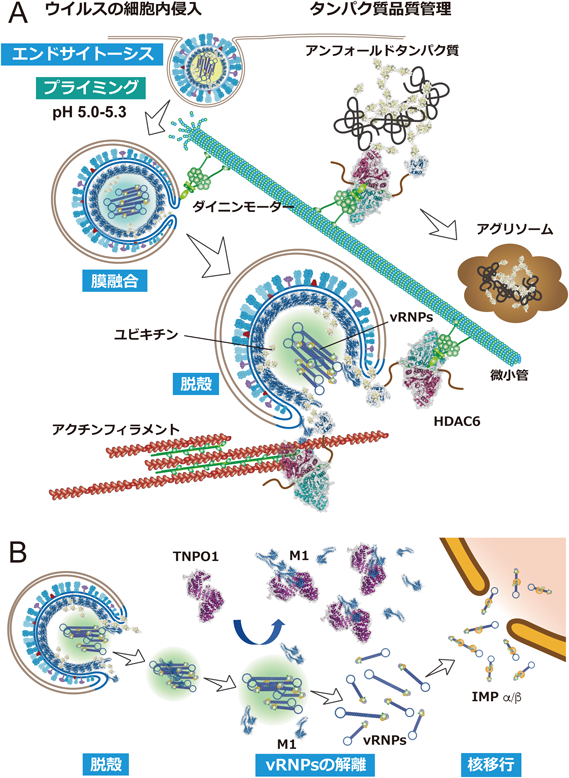
インフルエンザウイルスの細胞内侵入の生化学Biochemistry of influenza virus entry
1 名古屋大学大学院医学系研究科ウイルス学Nagoya University, Graduate School of Medicine, Department of Virology ◇ 〒466–8550 愛知県名古屋市昭和区鶴舞65番地 ◇ Tsurumai 65, Showa-ku, Nagoya, Aichi 466–8550, Japan
2 科学技術振興機構創発的研究支援事業JST, Fusion Oriented Research for disruptive Science and Technology (FOREST) ◇ 〒102–0076 東京都千代田区五番町7 K’s五番町 ◇ 〒102–0076 東京都千代田区五番町7 K’s五番町
3 名古屋大学高等研究院Nagoya University, Institute for Advanced Research (IAR) ◇ 〒464–8601 愛知県名古屋市千種区不老町 ◇ Furo-cho, Chikusa-ku, Nagoya, Aichi 464–8601, Japan
4 英国ブリストル大学ライフサイエンス学部細胞分子医科学科School of Cellular and Molecular Medicine, Faculty of Life Sciences, University of Bristol ◇ Biomedical Sciences Building, University Walk, Bristol BS8 1TD, UK ◇ Biomedical Sciences Building, University Walk, Bristol BS8 1TD, UK