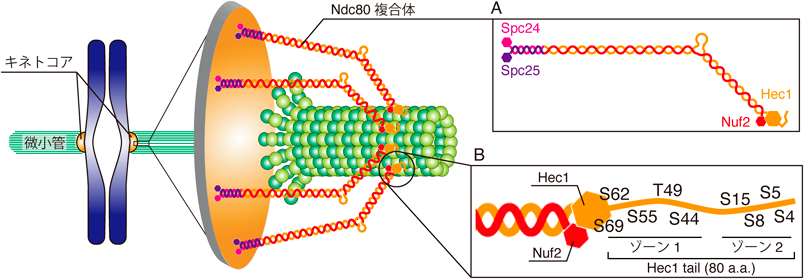
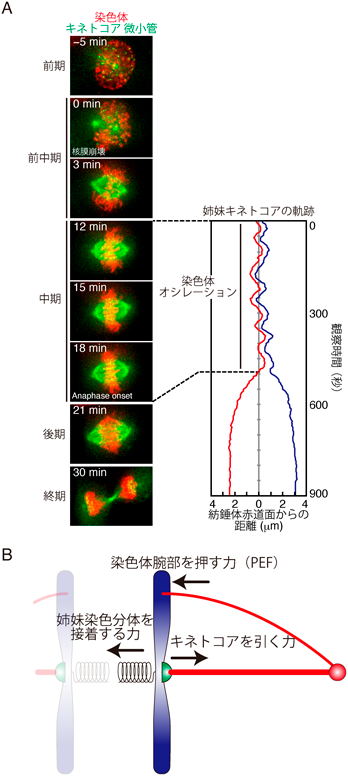
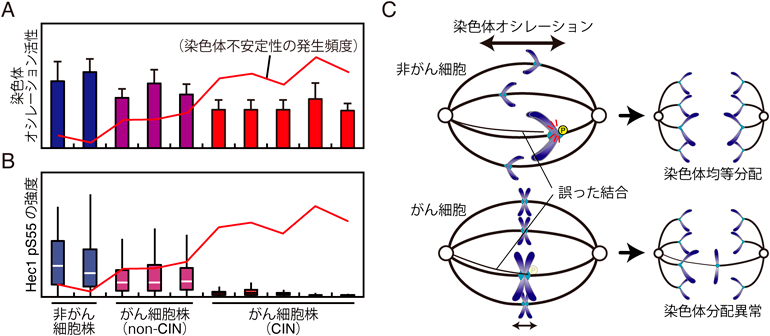
染色体分配における染色体オシレーションの役割Chromosome oscillation is required for robust chromosome segregation
東北大学加齢医学研究所分子腫瘍学研究分野Department of Molecular Oncology, Institute of Development, Aging and Cancer, Tohoku University ◇ 〒980–8575 宮城県仙台市青葉区星稜町4–1 ◇ Seiryo-machi 4–1, Aoba-ku, Sendai, Miyagi 980–8575, Japan