がん細胞には,ゲノムの一次配列や高次構造,クロマチンを含むエピゲノム修飾状態や転写産物などに,正常細胞とは異なるさまざまな量的・質的異常が認められる.次世代シークエンサーの発達により,こうした分子異常の網羅的な解析を大量並列的に行うことが可能となり,がんゲノムアトラス(The Cancer Genome Atlas:TCGA)1)や国際がんゲノムコンソーシアム(International Cancer Genome Consortium:ICGC)2)などで臨床がん組織に蓄積する包括的な分子異常のプロファイルがカタログ化されてきた.新規創薬標的の探索やゲノム情報に基づいた精緻化医療(precision medicine)への応用が期待されているが,小児にみられるような希少がんでは多数例のコホートでの解析結果がないだけでなく,成人のがんと異なる発がん機序がしばしばみられることから,その解明が十分でない.
本稿では,小児の肝悪性腫瘍で最も高頻度とされる肝芽腫(hepatoblastoma)に焦点をあて,その包括的なゲノム・エピゲノム解析の実例3)を紹介するとともに,分化制御因子の異常に伴う発がん機序について解説する.
2. 肝芽腫におけるゲノム異常および遺伝子発現異常
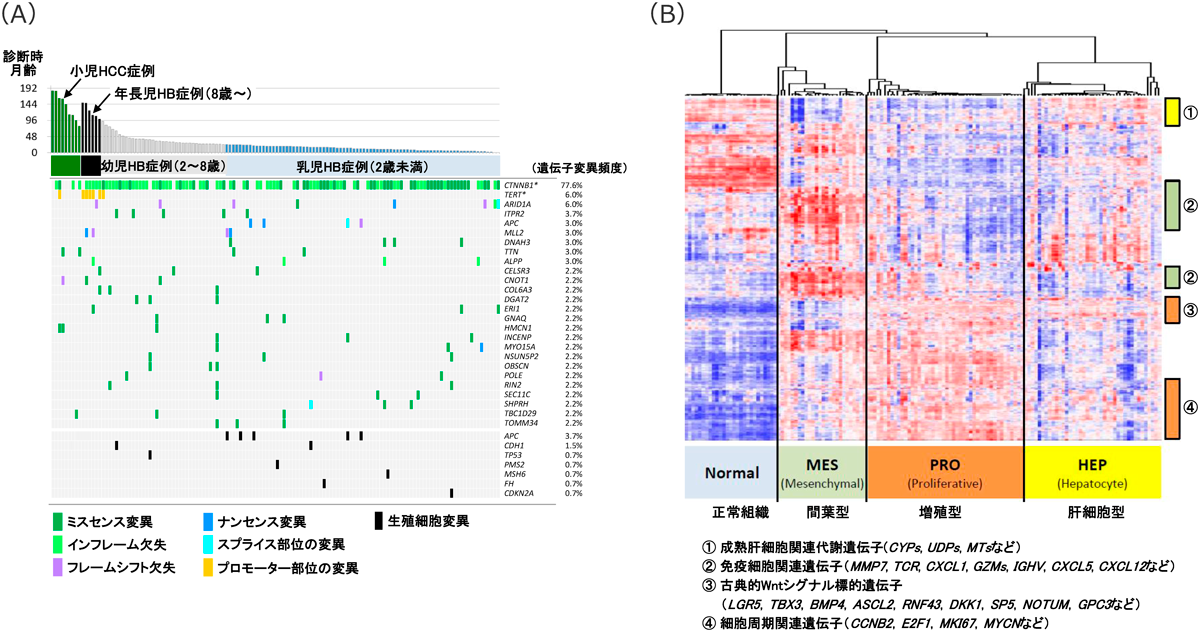
肝芽腫にみられる代表的なドライバー遺伝子異常としてWntシグナルの活性化に重要なβカテニン遺伝子(CTNNB1)が有名だが4),これまでには多数例の全エクソンシークエンス解析(whole exome sequencing:WXS)の報告がほとんどない状況であった.そこで,筆者らは日本小児肝がんスタディグループでのコホート症例5)(JPLT-2)163例の小児肝腫瘍(肝芽腫154例,肝細胞がん9例)について統合的ゲノムプロファイリングを実施した.
全エクソンシークエンス解析での体細胞変異の総数はエクソン領域で1 Mbあたり0.52個と非常に少ない結果であったが,CTNNB1やARID1A, ITPR2, APCなど25遺伝子のエクソン変異に加えて,テロメラーゼ逆転写酵素(TERT)にプロモーター変異を認めた(図1A).このTERT遺伝子は細胞不死化に必須な制御分子であるが,プロモーター変異が遺伝子発現の上昇に関連することが知られており,8歳以上の肝芽腫に選択的に認められた.
一方,SNPアレイを用いてゲノム高次構造を解析したところ,29%の症例にゲノム不安定性を認め,染色体コピー数の増加(1q, 2q, 20, 2p, 6p染色体)と減少(1p, 4q, 11q染色体)が確認された.さらに,アリル別でコピー数解析を追加することで34.2%の症例に染色体11pの片親性ダイソミー(uniparental disomy:UPD)がみられた.この領域はH19/IGF2を含むインプリンティング領域として知られており,IGF2の発現上昇が腫瘍細胞の増殖に関わるとされる重要な領域であるだけでなく,肝芽腫をしばしば合併する先天性疾患Beckwith–Wiedemann症候群の責任遺伝子座でもある6).
肝芽腫組織の多様な細胞学的性質を評価するために,RNAシークエンスによる遺伝子発現の網羅的解析を実施したところ,コンセンサスクラスタリング解析により三つの遺伝子発現サブタイプ(増殖型,間葉型,肝細胞型)が同定された(図1B).増殖型遺伝子発現を示す肝芽腫は,細胞周期関連遺伝子(CCNB2, E2F1, MKI67, MYCN)や肝がんの腫瘍マーカーAFPを有意に発現しており,高い細胞増殖活性を示唆するものである.古典的なWnt標的遺伝子(LGR5, TBX3, BMP4, ASCL2, RNF43, DKK1, SP5, NOTUM, GPC3)の発現も高く,CTNNB1変異を高頻度に有している.一方,間葉型遺伝子発現を示す肝芽腫では,T細胞受容体やマトリックスメタロプロテアーゼ(MMPs),グランザイム(GZMs)の発現が高く,免疫細胞の腫瘍内浸潤を示唆している.肝細胞型遺伝子発現を示す肝芽腫では,シトクロムP450(CYP)やUDPグルクロン酸転移酵素(UDP),メタロチオネインファミリー遺伝子(MT)など成熟した肝細胞代謝に関連する遺伝子が高発現しており,正常の肝細胞に近い機能を有する分化度の高い腫瘍と考えられた.
上記のようなゲノム異常や遺伝子発現異常は既知の報告とよく合致するものであったが,多様な形質を示す肝芽腫の発がん機序を説明するに十分でないため,DNAメチル化を中心としたエピゲノム解析を実施した.20例の全ゲノムバイサルファイトシーケンス解析(whole genome bisulfite sequencing:WGBS)に加えて,約45万か所のCpG領域を解析できるInfinium HumanMethylation450 BeadChip(Illumina社)を用いて157例の網羅的メチル化解析を行った.
前述のH19/IGF2の遺伝子座において,H19のインプリンティング領域(母方アリルのみ発現)では非がん部肝臓ではヘミメチル化されていたが,UPDやインプリンティング異常(loss of imprinting:LOI)を認める肝芽腫では完全にメチル化されており,肝芽腫の発がん過程で父方のアリルが優先的に選択される可能性が示唆された.一方,ヒトのIGF2では少なくとも五つのプロモーターが存在し,時空間的に厳密に制御されていることが知られている7).成人ヒト肝臓特異的プロモーターとして知られるプロモーター1(Pr1)は胎児肝では高度にメチル化されていたが,小児の非がん部肝臓では年齢依存的に低メチル化していく傾向を示した.一方,胎児組織特異的なプロモーター(Pr2)は,年齢依存的にメチル化が増加し,成人肝組織で高度なメチル化がみられた.これらの結果より,肝芽腫のIGF2プロモーターでは正常の肝細胞分化に伴うエピゲノム変化が起こらず,胎児肝の未熟細胞に由来するメチル化パターンが遷延している可能性が考えられた.
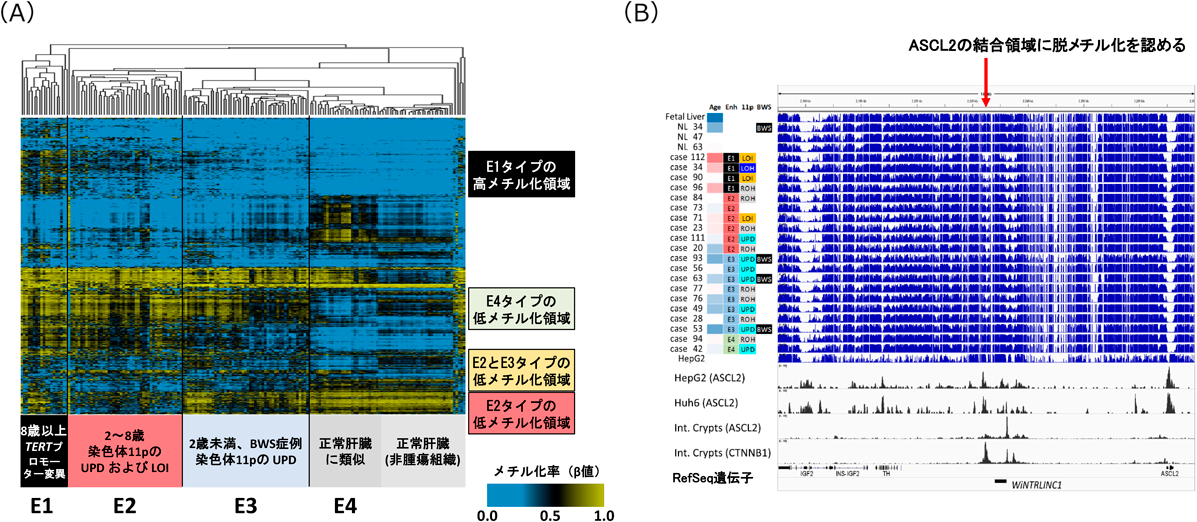
次に,肝細胞におけるエンハンサー領域に位置するCpG領域に特化したクラスター解析を実施し,肝芽腫のエンハンサーメチル化パターンが4種類(E1~E4)に分かれることを同定した(図2A).E1サブタイプは発症年齢が高い傾向にあり,病理組織学的にはHCN-NOS(hepatocellular neoplasia, not specified)8)が多くTERTプロモーター変異も高頻度に認めた.E2サブタイプはH19/IGF2領域のコピー数異常(UPDおよびLOI)と増殖型の遺伝子発現パターンを示し,高い分裂活性を持つ胚細胞型であることが示唆された.E4サブタイプは全体にエンハンサーメチル化異常が少ない傾向であったが,これは腫瘍含有率が低いための可能性が考えられた.
これらのサブタイプごとに特徴的なメチル化異常を解明すべく,それぞれに特異的な異常メチル化領域の周囲の配列に濃縮する転写因子のモチーフ解析を行った.E1サブタイプでの高メチル化領域はGCリッチ配列に富むことから,CpG密度が多いエンハンサー近傍が異常高メチル化の標的とされていることが示唆された.E4サブタイプにおける低メチル化領域ではETSなど血球系転写因子の認識配列が濃縮しており,免疫細胞浸潤とよく一致する結果であった.E2およびE3特異的低メチル化領域では,肝細胞分化におけるマスター制御因子(HNF4, COUP-TFs, PPAR)のDR1配列の有意な濃縮がみられ,肝細胞エンハンサーの低メチル化がE2・E3サブタイプの肝芽腫で保たれていることが示唆された.興味深いことに,E2特異的な低メチル化領域では,前述のDR1配列だけでなくE-box(Myogenin, NeuroD1など)の認識配列も濃縮していた.
前述のように,E2サブタイプの肝芽腫ではE-Box型転写因子の認識配列が低メチル化していたが,ここに結合する転写因子として肝芽腫で遺伝子発現が高いASCL2に注目した.TCGAで公開されているさまざまながん腫の遺伝子発現データベースを参照すると,意外なことにASCL2は成人の肝細胞がん(HCC)では発現レベルが非常に低いのに対して,大腸がんや胃がんなどの消化管腫瘍で高発現していることがわかった.さらに,このASCL2はH19/IGF2遺伝子座の近傍に位置しているだけでなく,大腸がんの9.9%,胃腺がんの2.7%にみられる局所的なゲノム増幅領域に含まれていることが判明した.この遺伝子座のoncogenicな責任遺伝子としてIGF2が考えられてきたが,ASCL2の高発現もこれに加担している可能性が考えられる.
さらに,最近の報告では,内胚葉分化におけるASCL2の重要な役割が注目されている.腸上皮細胞のオルガノイドモデルで有名なCleversらのグループはヒト腸管陰窩細胞を用いてASCL2のChIP-seq解析を行い,ASCL2がそれ自身の上流エンハンサー領域にCTNNB1とともに結合することで正のフィードバックループを形成し,これが腸管陰窩細胞の幹細胞性の維持に重要であることを示している9).別の報告において,ここで同定されたASCL2の結合領域はWntシグナルを制御する長鎖非コードRNA(WiNTRLINC1)のプロモーターに位置することが判明し,この長鎖非コードRNAによってASCL2のプロモーター領域と物理的な近接効果が生まれ,転写を正に制御することが報告されている10).
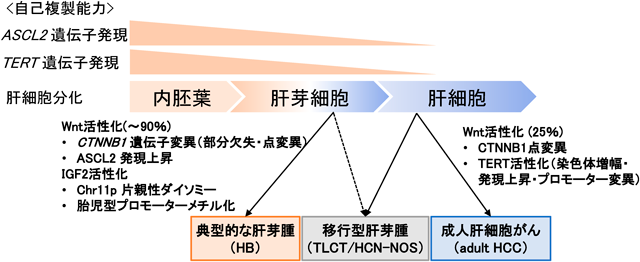
そこで,肝がん細胞株HepG2を用いてASCL2およびCTNNB1のChIP-seq実験を行い,ゲノムワイドな結合領域を解析したところ,ASCL2発現のエンハンサーとして働くWiNTRLINC1のプロモーター領域にASCL2がCTNNB1とともに結合していることが確認された(図2B).このASCL2の結合領域は,全ゲノムバイサルファイトシーケンスにて肝芽腫特異的に脱メチル化していることから,肝芽腫の臨床組織においてもASCL2の高発現とエンハンサー領域の異常低メチル化に伴う正のフィードバックループが働いている可能性が示唆された.これらの結果を総合すると,肝芽腫ではドライバー遺伝子異常としてCTNNB1のみしか同定されていないが,肝臓の未熟な細胞にみられるASCL2高発現とエピゲノム状態の異常な遷延がWnt活性化をさらに促進している可能性が考えられる(図3).
引用文献References
1) Weinstein, J.N., Collisson, E.A., Mills, G.B., Shaw, K.R., Ozenberger, B.A., Ellrott, K., Shmulevich, I., Sander, C., & Stuart, J.M., Cancer Genome Atlas Research Network. (2013) The Cancer Genome Atlas Pan-Cancer analysis project. Nat. Genet., 45, 1113–1120.
2) Hudson, T.J., Anderson, W., Artez, A., Barker, A.D., Bell, C., Bernabé, R.R., Bhan, M.K., Calvo, F., Eerola, I., Gerhard, D.S., et al.; International Cancer Genome Consortium. (2010) International network of cancer genome projects. Nature, 464, 993–998.
3) Nagae, G., Yamamoto, S., Fujita, M., Fujita, T., Nonaka, A., Umeda, T., Fukuda, S., Tatsuno, K., Maejima, K., Hayashi, A., et al. (2021) Genetic and epigenetic basis of hepatoblastoma diversity. Nat. Commun., 12, 5423.
4) Koch, A., Denkhaus, D., Albrecht, S., Leuschner, I., von Schweinitz, D., & Pietsch, T. (1999) Childhood hepatoblastomas frequently carry a mutated degradation targeting box of the beta-catenin gene. Cancer Res., 59, 269–273.
5) Hiyama, E., Hishiki, T., Watanabe, K., Ida, K., Ueda, Y., Kurihara, S., Yano, M., Hoshino, K., Yokoi, A., Takama, Y., et al. (2020) Outcome and Late Complications of Hepatoblastomas Treated Using the Japanese Study Group for Pediatric Liver Tumor 2 Protocol. J. Clin. Oncol., 38, 2488–2498. doi: 10.1200/JCO.19.01067.
6) Samuel, D.P., Tsokos, M., & DeBaun, M.R. (1999) Hemihypertrophy and a poorly differentiated embryonal rhabdomyosarcoma of the pelvis. Med. Pediatr. Oncol., 32, 38–43.
7) Rotwein, P. (2018) The complex genetics of human insulin-like growth factor 2 are not reflected in public databases. J. Biol. Chem., 293, 4324–4333.
8) Lopez-Terrada, D., Alaggio, R., de Dávila, M.T., Czauderna, P., Hiyama, E., Katzenstein, H., Leuschner, I., Malogolowkin, M., Meyers, R., Ranganathan, S., et al.; Children’s Oncology Group Liver Tumor Committee. (2014) Towards an international pediatric liver tumor consensus classification: proceedings of the Los Angeles COG liver tumors symposium. Mod. Pathol., 27, 472–491.
9) Schuijers, J., Junker, J.P., Mokry, M., Hatzis, P., Koo, B.K., Sasselli, V., van der Flier, L.G., Cuppen, E., van Oudenaarden, A., & Clevers, H. (2015) Ascl2 acts as an R-spondin/Wnt-responsive switch to control stemness in intestinal crypts. Cell Stem Cell, 16, 158–170.
10) Giakountis, A., Moulos, P., Zarkou, V., Oikonomou, C., Harokopos, V., Hatzigeorgiou, A.G., Reczko, M., & Hatzis, P. (2016) A Positive Regulatory Loop between a Wnt-Regulated Non-coding RNA and ASCL2 Controls Intestinal Stem Cell Fate. Cell Rep., 15, 2588–2596.
11) Grobner, S.N., Worst, B.C., Weischenfeldt, J., Buchhalter, I., Kleinheinz, K., Rudneva, V.A., Johann, P.D., Balasubramanian, G.P., Segura-Wang, M., Brabetz, S., et al.; ICGC PedBrain-Seq Project; ICGC MMML-Seq Project. (2018) The landscape of genomic alterations across childhood cancers. Nature, 555, 321–327.