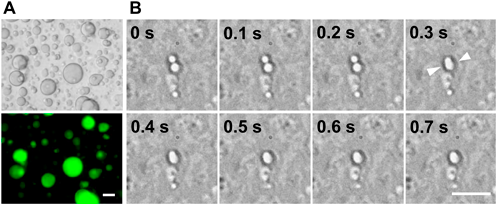
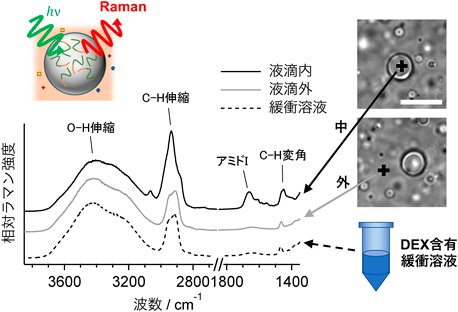
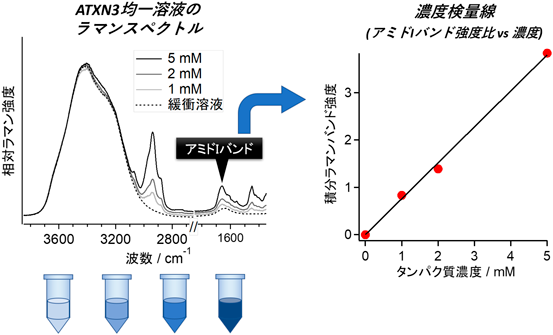
ラマン顕微鏡によるラベルフリーなタンパク質液滴定量法Label-free quantification of a protein liquid droplet using Raman microscopy
1 東北大学大学院薬学研究科Graduate School of Pharmaceutical Sciences, Tohoku University ◇ 〒980–8578 仙台市青葉区荒巻字青葉6–3 ◇ 6–3 Aoba, Aramaki, Aoba-ku, Sendai 980–8578, Japan
2 神戸学院大学薬学部Faculty of Pharmaceutical Sciences, Kobe Gakuin University ◇ 〒650–8586 神戸市中央区港島1–1–3 ◇ 1–1–3 Minatojima, Chuo-ku, Kobe 650–8586, Japan