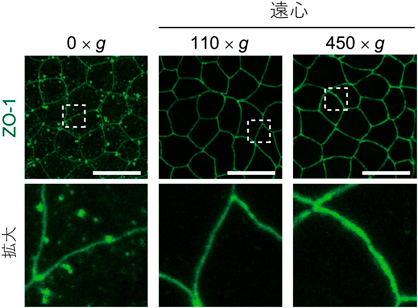
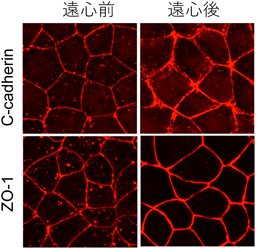
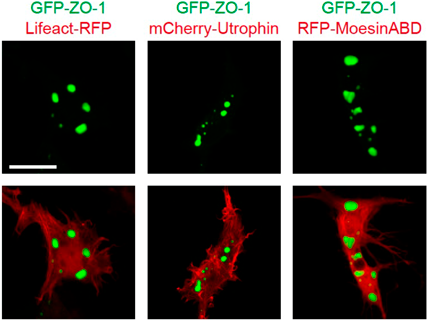
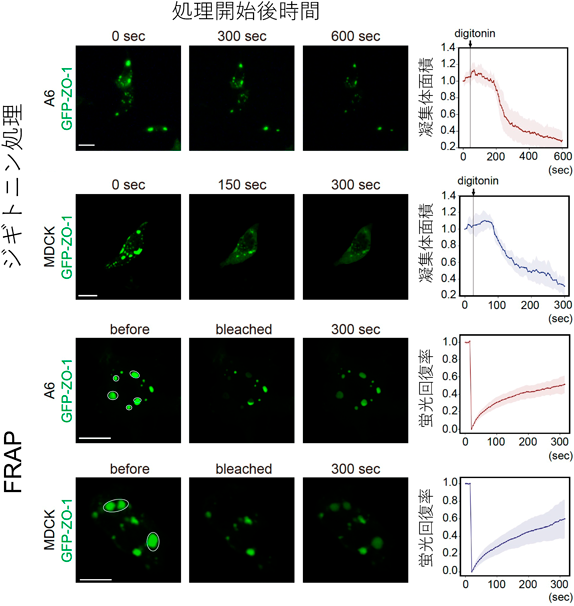
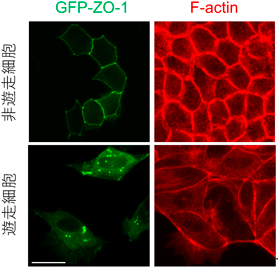
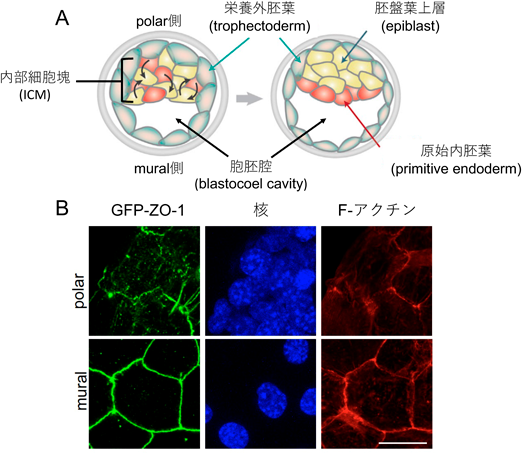
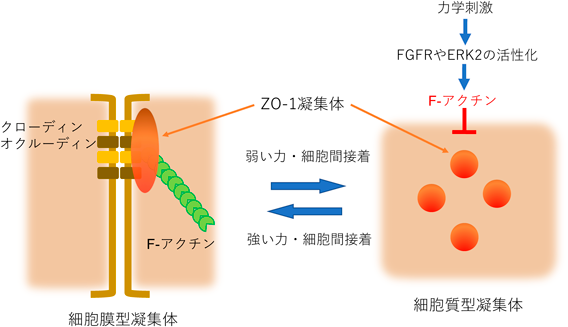
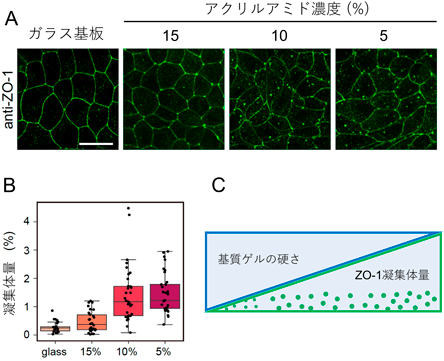
液–液相分離の制御を介した力学刺激依存的細胞間接着の調節機構―胚はどのように力にあらがい組織の統合性を維持するのか?Regulatory mechanism of cell–cell adhesion through the control of LLPS: How do embryos maintain their tissue integrity against forces?
1 自然科学研究機構・基礎生物学研究所・初期発生研究部門Division of Embryology, National Institute for Basic Biology ◇ 〒444–8787 愛知県岡崎市明大寺町字東山5–1 ◇ 5–1 Higashiyama, Myodaiji, Okazaki, Aichi 444–8787, Japan
2 自然科学研究機構・基礎生物学研究所・超階層生物学センターTrans-Scale Biology Center, National Institute for Basic Biology ◇ 〒444–8585 愛知県岡崎市明大寺町字西郷中38 ◇ 38 Nishigonaka, Myodaiji, Okazaki, Aichi 444–8585, Japan
3 名古屋市立大学大学院・医学研究科・細胞生化学分野Department of Cell Biology, Graduate School of Medical Sciences, Nagoya City University ◇ 〒467–8601 愛知県名古屋市瑞穂区瑞穂町川澄1 ◇ 1 Kawasumi, Mizuho-cho, Mizuho-ku, Nagoya, Aichi 467–8601, Japan
4 自然科学研究機構・国際連携研究センターInternational Research Collaboration Center, National Institutes of Natural Sciences ◇ 〒105–0001 東京都港区虎ノ門4–3–13 ◇ 4–3–13 Toranomon, Minato-ku, Tokyo 105–0001, Japan