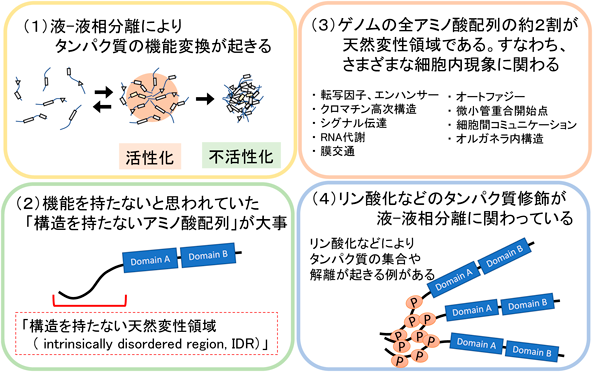
環境変化を感じた植物体内では,環境応答に必要な遺伝子の発現,代謝物の蓄積,タンパク質の機能変化,クロマチン構造の変化などさまざまな現象が起きている1).環境変化への迅速な対応を可能とするためのメカニズムの一つとして,近年,液–液相分離によるコンデンセート形成(図1)が注目されている2).コンデンセートは細胞内で特定のタンパク質やRNAが凝集した顆粒であり,天然変性領域(intrinsically disordered region:IDR)と呼ばれる「タンパク質の中で特定の立体構造を持たないペプチド配列」が互いに結合したり,他の構造を持つタンパク質やRNAなどに結合することによって形成される.このコンデンセートは,生体膜によって包まれていない顆粒であり,ある液体(細胞質や核質など)の中で「異なる物質で構成される液体(コンデンセート)」が存在している状態から,液–液相分離しているといわれる.
コンデンセートに含まれたタンパク質は,その形成前後でタンパク質の活性が増強,もしくは抑制されることが多い(図1).このタンパク質の活性変化は「リン酸化などのタンパク質自身の修飾による機能変換」が原因である場合も多いが,「顆粒形成による物理的な隔離効果」で説明できる場合も多い.たとえば,コンデンセート内で相互作用タンパク質や代謝基質の濃縮が起きた場合,タンパク質の修飾や構造の変化が起きなくても反応効率がきわめて高くなり,見かけ上の活性は上昇する.逆にコンデンセート内に相互作用タンパク質や代謝基質が入れなかった場合,反応効率は著しく低くなって見かけ上の活性は減少する.細胞内には,このような局所的に特定の物質濃度が偏ったコンデンセートが数多く形成されており,生体内反応のホットスポットが存在する.コンデンセートによるタンパク質の機能制御の特徴として,すばやいコンデンセート形成と分解(早い例では数秒以内)によってタンパク質機能のON/OFFをすばやく切り替えることがあげられ,これは転写や翻訳,タンパク質分解などを介した遺伝子発現制御と大きく異なる点である.
環境刺激によって誘導される植物のコンデンセートの一つとして,光の感受に関わるフィトクロムやクリプトクロムなどの光受容体は,光を感受すると核内で明確なコンデンセートを形成して遺伝子発現を制御する3, 4).シロイヌナズナのフィトクロムB(phyB)は光受容体であるが温度感受にも関わっており,12°Cから27°Cの温度変化において高温時にはphyBは不活性化状態へと変わり,その際に核内のphyBコンデンセートが徐々に分解される5, 6).同様の温度域では,サーカディアンリズムの主要因子であるシロイヌナズナのELF3にプリオン様天然変性領域が存在し,この天然変性領域依存的に高温依存的な核内コンデンセートが形成されることが知られている5).シロイヌナズナとは異なる温度域が原産であるジャガイモ(ナス科)やミナトカモジグサ(イネ科)では,プリオン様天然変性領域が天然変性領域として認識できないほどに変異を起こしており,温度感受性が失われることが実験的に示されている5).
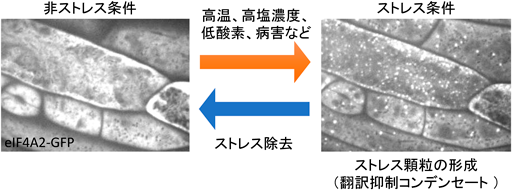
またさらに高い温度に対する適応メカニズムとして,翻訳抑制コンデンセートとして知られるストレス顆粒がある.ストレス顆粒は細胞の生死に関わるような強いストレスを受けた際に緊急避難的にハウスキーピングタンパク質の翻訳を停止し,緊急時に必要とされるタンパク質群の翻訳を促進することで細胞内タンパク質構成を劇的に変化させる役割を担っている.植物では高温ストレスや乾燥ストレス,塩ストレス,低酸素ストレス,および,病害応答を意味するメチルジャスモン酸の曝露に応答してストレス顆粒が現れることが知られている7–13).このストレス顆粒は植物のみならず,すべての真核生物において共通して形成される(図2).たとえばヒトの細胞では,高温ストレス,亜ヒ酸塩曝露,ウイルス感染,紫外線照射によってストレス顆粒が誘導されることが知られている14).またストレス顆粒がアルツハイマー病,筋萎縮性側索硬化症,前頭側頭葉変性症などのヒト疾患と関連していることも報告されている15, 16).ストレス顆粒は環境刺激によって誘導される植物コンデンセートの中では最もよく研究されており,本稿では植物のストレス顆粒について詳しく紹介する.
植物,動物,酵母で報告されているストレス顆粒の構成タンパク質群は大部分が共通している.細胞が危機的なストレスにさらされるとmRNA,翻訳開始因子,ポリA結合タンパク質,40Sリボソームタンパク質などの翻訳装置の構成要素と特定のRNA結合タンパク質が液–液相分離による凝集を引き起こし,ストレス顆粒が形成される.このストレス顆粒の形成は構成因子となるタンパク質にGFPを融合させることで可視化することが可能である(図2).ストレスが短期間で解消された場合,ストレス顆粒の構成因子は再び細胞質へと拡散し,構成因子は再び翻訳に用いることができる.
ストレス顆粒には翻訳途中のmRNAは含まれず,翻訳開始前に形成される翻訳開始複合体(pre-initiation complex:PIC)が結合した状態のmRNAが含まれる.動物や酵母の細胞での知見では,PICの中で特にストレス顆粒形成開始に重要であるといわれているのがeIF2αのリン酸化やeIF4Aの不活性化である.リン酸化されたeIF2αはメチオニンの翻訳開始コドンへのリクルートを阻害し,翻訳阻害型の48S開始複合体が形成される.1本のmRNAに多数のリボソームが翻訳を行っているポリソームに翻訳阻害型の48S開始複合体が結合した場合,新たなリボソームによる翻訳は開始されないが翻訳に働いていたリボソームは解離していく17, 18).また動物や酵母の細胞ではリン酸化eIF2αとは異なるストレス顆粒形成メカニズムであるeIF4Aの不活性化も知られている19).eIF4AはmRNAの5′UTRをほぐして翻訳開始の促進を助ける役割を担うRNA helicaseであり20),活性化されたeIF4Aはストレス顆粒の形成を抑制する因子として働く21).これらeIF2αやeIF4Aの翻訳開始因子は真核生物に共通した因子であり,植物での解析は行われていないが同様のメカニズムが存在する可能性が高い.
3. 植物における真核生物に共通したストレス顆粒形成因子
ストレス顆粒の形成に関わる有名なRNA結合タンパク質としてTIA-1(T-cell-restricted intracellular antigen-1)やG3BP(Ras-GAP SH3 domain binding protein),TSN(Tudor staphylococcal nuclease)などがあげられる.TIA-1は,N末端側の三つのRNA認識モチーフ(RRM)とC末端側のプリオン様天然変性領域を持つストレス顆粒形成に必要な因子である22).このTIA-1と近縁なRNA結合タンパク質として,植物ではRBP45/47ファミリーとUBP1ファミリー(Oligouridylate-binding protein 1)が同定されている.RBP45/47ファミリーのRBP47Bはストレス顆粒マーカーとしてよく使われており,高温ストレス,塩ストレス,低酸素ストレスに応答したストレス顆粒形成が観察されている9, 12, 13, 23).一方,UBP1ファミリーに属するUBP1AとUBP1Cは高温ストレスと低酸素ストレスに,UBP1Bは高温ストレスに応答したストレス顆粒形成が観察されている11, 24, 25).植物は冠水することによって低酸素状態になるが,UBP1Cの変異体や発現量低下株では低酸素ストレス下での生存率が下がることが知られている.また低酸素ストレス下で形成されるストレス顆粒には,3′UTRにウラシルが豊富なmRNAが特に濃縮されていた11).また高温ストレスに対してUBP1Bの過剰発現体は強くなり,欠失変異体は弱くなることが示されている24).
動物細胞におけるG3BPの発現はストレス顆粒形成を誘導することが知られている26).またG3BPはウイルスとの関連が多く報告されている27).ウイルスが感染した細胞では,さまざまなレベルでの細胞ストレスが引き起こされ,ストレス顆粒の形成やmRNAの脱キャップを担うP-bodyの増加のようなコンデンセートの変化やオートファジー,アポトーシスなどが起きる.ウイルス感染時の自然免疫で重要な役割を果たすインターフェロンに応答するPKR(protein kinase R)は,麻疹ウイルスや変異型A型インフルエンザウイルスの感染時にストレス顆粒と共局在化する28, 29).さらにG3BP1の過剰発現はコクサッキーウイルスB3のウイルスタンパク質の発現とウイルスの感染力を減少させ,逆にG3BP1の発現量を下げることで若干のウイルスタンパク質やRNAの増加が確認されている30).また近年では新型コロナウイルス(SARS-CoV-2)のヌクレオカプシドタンパク質(N)の相互作用タンパク質としてG3BPが同定されている31).新型コロナウイルスの感染時にはストレス顆粒の形成が観察されること,G3BPの発現量低下は新型コロナウイルスの複製を増加させること,ヌクレオカプシドタンパク質はストレス顆粒形成を阻害すること,ヌクレオカプシドタンパク質はG3BPと他のストレス顆粒構成因子との相互作用を阻害することなどが明らかにされている32–34).
シロイヌナズナゲノムには少なくとも7遺伝子のG3BPが存在しており,それらの一過的発現系による局在解析ではすべてのG3BPがストレス顆粒様の顆粒に局在することが確認されている35).またAbulfarajらはG3BPタンパク質のドメインが含まれる別の遺伝子(AT3G07250)もG3BPであるとし,シロイヌナズナのG3BPを8遺伝子としている36).現時点ではKrenzらのグループとAbulfarajらのグループでG3BPのナンバリングが異なっており,本稿では混乱を避けるために遺伝子名ではなく,共通で使用されている遺伝子コードを附した.
植物のG3BPがストレス顆粒に局在することを初めて示したのはKrenzらのグループであり,彼らはエンドウえそ黄萎ウイルスとアブロチンモザイクウイルスの核シャトルタンパク質との相互作用因子としてG3BP(AT5G43960)を同定した37).さらに,Krenzらはカブモザイクウイルスのプロテアーゼ(P1)がG3BP(AT5G43960, AT1G69250)と共局在していることを示している38).G3BPとこれらのウイルスタンパク質の関係は不明であるが,動物細胞での知見を参考にすると,これらのタンパク質がG3BPの機能抑制や分解をすることでストレス顆粒形成を阻害している可能性が考えられる.
一方,植物のG3BP(AT5G48650)の欠失変異体はウイルスのみならず,植物病原菌であるシュードモナスの感染に対して抵抗性を持つことも明らかにされた36).G3BP(AT5G48650)の変異体では細菌の侵入を防ぐように気孔が閉じており,病害応答時に働くサリチル酸レベルが高く,防御遺伝子の発現が高まっていた.また逆にG3BP(AT5G48650)の過剰発現体ではシュードモナスに感染しやすいことが示されている36).
TSNは転写制御やスプライシング,small RNAを介したRNAサイレンシングに関わる真核生物に広く保存された多機能タンパク質であり,ストレス顆粒の構成因子としても知られている.植物では,TSNはイネの種子胚乳の小胞体内において高濃度に蓄積されるプロラミンタンパク質のmRNAの3′UTRに結合する因子として同定された39).プロラミンmRNAはプロラミンが貯まるPB-ER(prolamine body-endoplasmic reticulum)の表面に局所的に蓄積し,このPB-ERは微小管とアクチン繊維に沿って局在している40–42).このイネのTSNを過剰発現させるとプロラミンとグルテリンのmRNA蓄積量が増え,タンパク質量が減少することが知られており,mRNAの安定性とタンパク質合成において何らかの役割を果たしていることが示唆されている43).さらにシロイヌナズナで得られたTSNの欠失変異体では,高塩濃度ストレスに対する耐性低下,環境ストレスによる成長阻害,稔性低下などが引き起こされており,さまざまな非生物的ストレスに対して弱くなっていることが示されている44, 45).またTSNはプログラム細胞死が起きる際の引き金となるプロテアーゼの分解ターゲットとしても同定されている44).
このシロイヌナズナのTSN1やTSN2は高塩濃度ストレスや高温ストレス条件下でストレス顆粒やmRNAの脱キャップを担うP-bodyに局在していた13, 14).TSNの欠失変異体ではmRNAの変動も観察され,ストレス耐性に関わるような膜交通タンパク質群の減少45)や,高温ストレスで引き起こされるmRNAの脱キャップの減少14)が報告されており,これらのmRNAの安定化制御にはストレス顆粒やP-bodyが関わる可能性が示唆されている.
4. ストレス顆粒とヒートショックタンパク質の関係
トマト培養細胞や植物体を高温処理した際にヒートショック顆粒(heat shock granules/heat stress granules:HSGs)と呼ばれる凝集体が形成され,そこにはヒートショックタンパク質群(heat shock proteins:HSPs)のmRNAを除いた多くのハウスキーピングタンパク質をコードするmRNAが多量に含まれていることが明らかにされた7, 8).これがストレス顆粒の発見だといわれている46).その後,動物細胞で転写翻訳されたHSPsがHSGsに局在することが示され,HSGsとストレス顆粒は同一の構造であることが示されている22, 47, 48).トマト培養細胞ではストレス顆粒にはHSP17が共局在しないという報告もあるが9),シロイヌナズナの根の表皮細胞でHSP101がストレス顆粒に共局在する例49)や,HSP70からHSP90への変性タンパク質の受け渡しに重要であるHSP70-HSP90 organizing protein(HOP)がストレス顆粒に共局在する例50)が知られている.そのため一部の植物種や組織,HSPsの種類によって異なる可能性もあるが,植物においても多くのHSPsはストレス顆粒と共局在するようである.McLoughlinらは,HSP101の相互作用タンパク質としてユビキチン–プロテアソーム系のタンパク質群を同定し,HSPやストレス顆粒とプロテアソーム系のタンパク質群が共局在することを明らかにしている49).さらに,ストレス顆粒を含むと思われるユビキチン化された不溶性画分の分解がHSP101欠失変異体やsHSPの発現抑制体において起こりにくいことを示し,HSPsがストレス顆粒の分解に働くことが示唆されている49).
ジンクフィンガードメインを持つ植物独特なストレス顆粒構成因子としてTZFやVOZなどが知られている.TZFとVOZはともに細胞質と核に局在する転写因子であり,ストレス依存的にストレス顆粒やP-bodyへと集積する10, 51, 52).シロイヌナズナではTZFはジベレリンやアブシジン酸による成長制御に関わり53),亜鉛の存在下でpoly(U)RNAと強く結合してAU-rich elementを含むmRNAの崩壊を引き起こす54).一方,イネのTZFはアブシジン酸やメチルジャスモン酸,サリチル酸などの植物ホルモンや乾燥,高塩分ストレス,過酸化水素で発現誘導されることが知られ,mRNAのU-richな3′UTRに結合することが示されている51).イネTZFの過剰発現体では発芽遅延や成長遅延,葉の老化遅延,高塩濃度ストレスと乾燥ストレスに対する耐性が観察されており,RNAiノックダウンによる発現減少株では逆の表現型が観察されている51).
VOZは1個のジンクフィンガードメインを持ってDNAに結合する転写因子として同定され,シロイヌナズナにおいて2遺伝子座が知られている55).VOZは植物の花成因子であるFTやCOと相互作用することが知られており56, 57),近年では高温や乾燥ストレスに働くDREB2Cとも相互作用することが示されている58).シロイヌナズナVOZ1/VOZ2の二重欠失変異体は低温や乾燥ストレスに強くなり59),VOZの過剰発現体は低温や乾燥ストレスに弱くなる60).またVOZの二重欠失変異体では,真菌であるColletotrichum higginsianumや細菌であるPseudomonas syringaeに対する抵抗性が著しく低下したが59),VOZの過剰発現体では真菌に対する抵抗性が上昇した60).YasuiらはVOZ1/VOZ2の二重欠失変異体が長日条件で示す遅咲きの表現型が,核移行シグナルをつけた核局在型のVOZ1によって回復するが,核外移行シグナルをつけた細胞質局在型のVOZ1は回復しなかったことを示している56).これはVOZ1が細胞質のストレス顆粒ではなく核内で機能していることを意味している.現時点ではVOZやTZFの機能のうち,どれがストレス顆粒に関連した機能であるかは不明であり,今後の解析が期待される.また植物独特のストレス顆粒構成因子としてはAngustifolia(AN)やCML38なども知られており23, 61),これらがストレス顆粒に局在する理由や意義については今後の研究が期待される.
上述したように植物のストレス顆粒は高温や乾燥,高塩濃度,低酸素,病害応答などさまざまなストレスによって誘導され,ストレス顆粒内に含まれる多くの因子の存在が明らかとなっている.これまでの多くの研究では,ストレス顆粒を形成させるために39°Cから42°C程度の温度で数十分から1時間程度の処理が施されており,短時間の高温処理の例としてはWeberらは39°C, 15分の条件,Gutierrez-Beltranらは39°C, 10分の条件で行っている9, 13).しかしながら「どれくらいのストレスが植物に与えられるとストレス顆粒が形成されるのか」という基礎的な実験データは報告されていなかった.そこで筆者らは,ストレス顆粒研究を開始する際に,まずストレス顆粒形成の条件を詳細に調べた62).
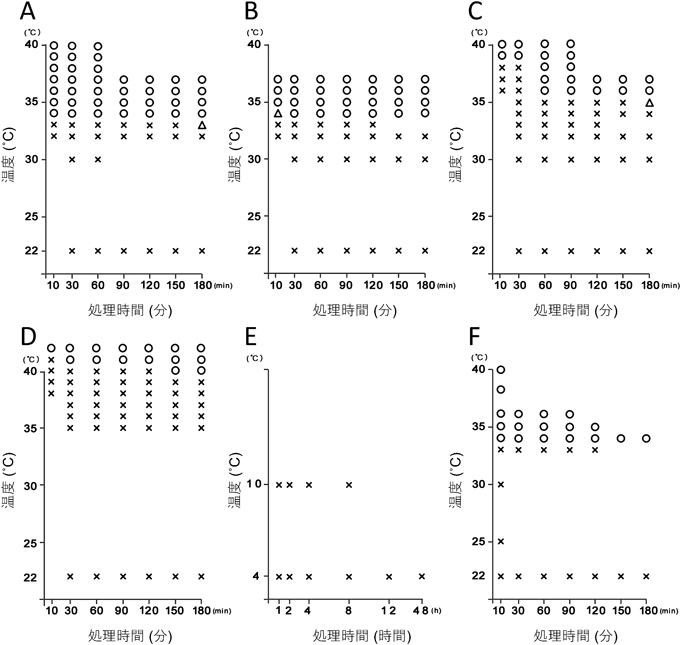
大半のコンデンセートは非常に小さな顆粒が形成され,その後,コンデンセート同士が融合して徐々に大きくなることが知られている.そこで我々は微小なストレス顆粒も観察することが可能な高感度・高画素のsCMOSカメラを装備したスピニングディスク型コンフォーカル顕微鏡を用い,30°Cから43°Cまで1°Cずつ段階的に設定したインキュベーターによってストレス顆粒形成の有無を調べた62).発芽後5日目の幼植物体をカバーガラス上にビニールテープで作製したチャンバー内に水没させ,10分の高温処理を行った場合,ストレス顆粒は33°Cでは形成されず34°C以上の温度で形成された(図3A).ストレス顆粒の数は,温度上昇に比例して増加していた.また33°Cの高温処理では2時間経ってもストレス顆粒は形成されず,植物では弱いストレスは蓄積せず,ストレス顆粒の形成を引き起こさないことが明らかとなった(図3A).このことより植物にはストレス顆粒形成の閾値温度が存在することが明らかとなった.また植物は蒸散を行っており,根から吸った水分を葉や茎の気孔から揮発させることにより体温を下げることができる.我々は植物研究でよく用いられる異なる四つの処理方法における細胞質でのストレス顆粒形成を観察することにより,蒸散の効果によって細胞質の温度が5~7°C程度冷やされていることを明らかにした(図3A~D).このことは植物のストレス顆粒研究を行う上で,注意すべき点である.
7. 植物ストレス顆粒は相対的な温度差では形成されない
植物が生育している野外では,昼間と夜間の温度差がある.我々は低温環境で育った植物において,ストレス顆粒の形成閾値温度がどのように変化するかを調べた62).ストレス顆粒は10°Cや4°Cの低温で誘導されない(図3E).そこで4°Cで2日間処理した植物を用いてストレス顆粒の形成閾値温度を調べると,22°Cで育てた植物同様にストレス顆粒の形成には34°Cの高温処理が必要であった(図3F).4°Cから22°Cの温度上昇では18°Cの温度変化,4°Cから33°Cの温度上昇では29°Cの温度変化があり,刺激としては十分であるにもかかわらずストレス顆粒が形成されない.このことは,植物のストレス顆粒は相対的な温度差では形成されず,絶対的な閾値温度を超えることがストレス顆粒形成のトリガーとなっていることを示している.一方,我々は高温ストレスとは異なる高塩濃度ストレスを同時に与えた場合には,ストレス顆粒形成の閾値温度が下がることも見いだしている62).そのため複数の異なるストレスが存在する状態では,閾値温度は柔軟に変化するのだろう.
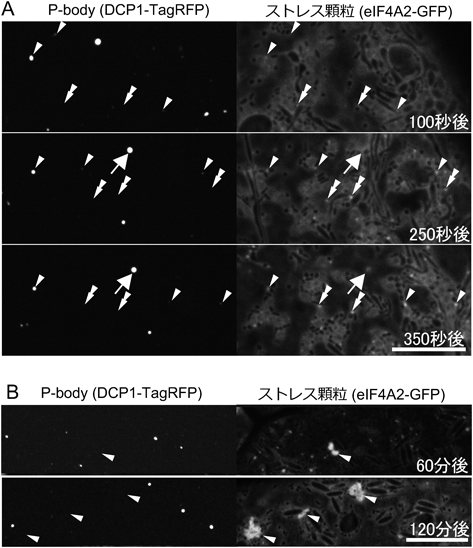
ストレス顆粒形成に必要な閾値温度(最低温度)が明らかになったことにより,穏やかな高温処理条件において詳細なストレス顆粒の形成過程を解析できるようになった.真核生物全般において,ストレス顆粒はP-bodyに隣接して現れることが多く,P-bodyはストレス顆粒の形成促進を行うとされている9, 63, 64).そこで我々は,顕微鏡ステージ上に設置したヒートインキュベーターを用いてストレス顆粒の形成過程を観察した62).30秒で試料温度を35°Cに上昇させた場合,処理開始後約70秒でストレス顆粒が形成され始めた.ストレス顆粒はP-bodyの近傍に形成されるものもあれば(図4A,矢じり),P-bodyとは独立して形成されるものもあった(図4A,二重矢じり).100秒後ではP-bodyの半数がストレス顆粒と結合しておらず,250秒後でもストレス顆粒と結合していないP-bodyもあった(図4A, 250秒後矢印).この観察結果を解析したところ,P-bodyがストレス顆粒の形成促進を行うことはなかった.また高温処理によりストレス顆粒同士やP-body同士は融合を繰り返すことが以前の報告13, 65)と同様に観察された.P-bodyとストレス顆粒が接着する場合もみられ,高温処理時間が長くなるにつれて大半のP-bodyはストレス顆粒と共局在した.そのため,さらに長い時間の高温処理により,P-bodyは巨大なストレス顆粒の内部に含まれると予想した.しかしながら,マイクロチューブ法を用いて35°Cで1時間以上の高温処理をした場合,予想に反してP-bodyは巨大なストレス顆粒と独立していた(図4B).また短時間の高温処理時にP-bodyとストレス顆粒が共局在していると思われた顆粒においても,高解像度の解析ではストレス顆粒はP-bodyと完全に融合していなかった.そのため我々が使用したマーカーを使う限りにおいては,ストレス顆粒とP-bodyは独立した構造であり,互いに接着はするが融合しないことが明らかとなった.
細胞内には液–液相分離によって形成されるコンデンセートが無数に存在すると考えられ,現時点ではどれくらいの種類があるかはまったく想像できない.現在,天然変性領域の重要性が理解され,コンデンセートの解析方法も確立されつつある.「液–液相分離によるコンデンセート形成」と「天然変性領域の重要性」が明らかとなった今,分子メカニズムが解明されてこなかった多くの細胞内現象の理解が一気に進む可能性が高い.
私自身は微小管付随タンパク質群の専門家として微小管上で形成されるさまざまな顆粒(ストレス顆粒を含む)に興味を持って研究を行い,結果的にその大半が液–液相分離によって形成されたコンデンセートであった.私は微小管が「細胞質コンデンセート形成の足場」としてさまざまな細胞内現象の中心となっていると信じているが,コンデンセートの普遍性が徐々に明らかになるにつれて「微小管じゃなくてもよいかもね」と思うことも多い.微小管は現時点でも有力な「細胞質コンデンセートの形成の足場」であると思うが,今後の研究発展によって,それがどのように変わっていくのかを楽しみたい.
謝辞Acknowledgments
植物コンデンセート研究を始める後押しをしていただいた京都大学大学院理学研究科の西村いくこ教授と本格的なコンデンセート研究へ導いていただいた東京大学大学院総合文化研究科の渡邊雄一郎教授に心より感謝いたします.また岡山理科大学にてコンデンセート研究の礎と発展に尽力していただいている東京大学大学院理学系研究科の武井敬仁氏と,これまでに研究に携わっていただいた多くの研究室メンバーの皆さんに深く感謝いたします.
引用文献References
1) Zhang, H., Zhu, J., Gong, Z., & Zhu, J.K. (2022) Abiotic stress responses in plants. Nat. Rev. Genet., 23, 104–119.
2) Kim, J., Lee, H., Lee, H.G., & Seo, P.J. (2021) Get closer and make hotspots: liquid-liquid phase separation in plants. EMBO Rep., 22, e51656.
3) Yamaguchi, R., Nakamura, M., Mochizuki, N., Kay, S.A., & Nagatani, A. (1999) Light-dependent translocation of a phytochrome B-GFP fusion protein to the nucleus in transgenic Arabidopsis. J. Cell Biol., 145, 437–445.
4) Yu, X., Sayegh, R., Maymon, M., Warpeha, K., Klejnot, J., Yang, H., Huang, J., Lee, J., Kaufman, L., & Lina, C. (2009) Formation of nuclear bodies of Arabidopsis CRY2 in response to blue light is associated with its blue light-dependent degradation. Plant Cell, 21, 118–130.
5) Jung, J.H., Domijan, M., Klose, C., Biswas, S., Ezer, D., Gao, M., Khattak, A.K., Box, M.S., Charoensawan, V., Cortijo, S., et al. (2016) Phytochromes function as thermosensors in Arabidopsis. Science, 354, 886–889.
6) Hahm, J., Kim, K., Qiu, Y., & Chen, M. (2020) Increasing ambient temperature progressively disassembles Arabidopsis phytochrome B from individual photobodies with distinct thermostabilities. Nat. Commun., 11, 1660.
7) Nover, L., Scharf, K.D., & Neumann, D. (1983) Formation of cytoplasmic heat shock granules in tomato cell cultures and leaves. Mol. Cell. Biol., 3, 1648–1655.
8) Nover, L., Scharf, K.D., & Neumann, D. (1989) Cytoplasmic heat shock granules are formed from precursor particles and are associated with a specific set of mRNAs. Mol. Cell. Biol., 9, 1298–1308.
9) Weber, C., Nover, L., & Fauth, M. (2008) Plant stress granules and mRNA processing bodies are distinct from heat stress granules. Plant J., 56, 517–530.
10) Pomeranz, M.C., Hah, C., Lin, P.C., Kang, S.G., Finer, J.J., Blackshear, P.J., & Jang, J.C. (2010) The Arabidopsis tandem zinc finger protein AtTZF1 traffics between the nucleus and cytoplasmic foci and binds both DNA and RNA. Plant Physiol., 152, 151–165.
11) Sorenson, R. & Bailey-Serres, J. (2014) Selective mRNA sequestration by OLIGOURIDYLATE-BINDING PROTEIN 1 contributes to translational control during hypoxia in Arabidopsis. Proc. Natl. Acad. Sci. USA, 111, 2373–2378.
12) Yan, C., Yan, Z., Wang, Y., Yan, X., & Han, Y. (2014) Tudor-SN, a component of stress granules, regulates growth under salt stress by modulating GA20ox3 mRNA levels in Arabidopsis. J. Exp. Bot., 65, 5933–5944.
13) Gutierrez-Beltran, E., Moschou, P.N., Smertenko, A.P., & Bozhkov, P.V. (2015) Tudor staphylococcal nuclease links formation of stress granules and processing bodies with mRNA catabolism in Arabidopsis. Plant Cell, 27, 926–943.
14) Kedersha, N., Ivanov, P., & Anderson, P. (2013) Stress granules and cell signaling: more than just a passing phase? Trends Biochem. Sci., 38, 494–506.
15) Wolozin, B. (2012) Regulated protein aggregation: stress granules and neurodegeneration. Mol. Neurodegener., 7, 56.
16) Vanderweyde, T., Youmans, K., Liu-Yesucevitz, L., & Wolozin, B. (2013) Role of stress granules and RNA-binding proteins in neurodegeneration: a mini-review. Gerontology, 59, 524–533.
17) Kedersha, N., Chen, S., Gilks, N., Li, W., Miller, I.J., Stahl, J., & Anderson, P. (2002) Evidence that ternary complex (eIF2-GTP-tRNA(i)(Met))-deficient preinitiation complexes are core constituents of mammalian stress granules. Mol. Biol. Cell, 13, 195–210.
18) Kimball, S.R., Horetsky, R.L., Ron, D., Jefferson, L.S., & Harding, H.P. (2003) Mammalian stress granules represent sites of accumulation of stalled translation initiation complexes. Am. J. Physiol. Cell Physiol., 284, C273–C284.
19) Kedersha, N., Panas, M.D., Achorn, C.A., Lyons, S., Tisdale, S., Hickman, T., Thomas, M., Lieberman, J., McInerney, G.M., Ivanov, P., et al. (2016) G3BP-Caprin1-USP10 complexes mediate stress granule condensation and associate with 40S subunits. J. Cell Biol., 212, 845–860.
20) García-García, C., Frieda, K.L., Feoktistova, K., Fraser, C.S., & Block, S.M. (2015) RNA BIOCHEMISTRY. Factor-dependent processivity in human eIF4A DEAD-box helicase. Science, 348, 1486–1488.
21) Tauber, D., Tauber, G., Khong, A., Van Treeck, B., Pelletier, J., & Parker, R. (2020) Modulation of RNA Condensation by the DEAD-Box Protein eIF4A. Cell, 180, 411–426.e16.
22) Kedersha, N.L., Gupta, M., Li, W., Miller, I., & Anderson, P. (1999) RNA-binding proteins TIA-1 and TIAR link the phosphorylation of eIF-2 alpha to the assembly of mammalian stress granules. J. Cell Biol., 147, 1431–1442.
23) Lokdarshi, A., Craig Conner, W., McClintock, C., Li, T., & Roberts, D.M. (2016) Arabidopsis CML38, a calcium sensor that localizes to ribonucleoprotein complexes under hypoxia stress. Plant Physiol., 170, 1046–1059.
24) Nguyen, C.C., Nakaminami, K., Matsui, A., Kobayashi, S., Kurihara, Y., Toyooka, K., Tanaka, M., & Seki, M. (2016) Oligouridylate binding protein 1b plays an integral role in plant heat stress tolerance. Front. Plant Sci., 7, 853.
25) Nguyen, C.C., Nakaminami, K., Matsui, A., Watanabe, S., Kanno, Y., Seo, M., & Seki, M. (2017) Overexpression of oligouridylate binding protein 1b results in ABA hypersensitivity. Plant Signal. Behav., 12, e1282591.
26) Tourrière, H., Chebli, K., Zekri, L., Courselaud, B., Blanchard, J.M., Bertrand, E., & Tazi, J. (2003) The RasGAP-associated endoribonuclease G3BP assembles stress granules. J. Cell Biol., 160, 823–831.
27) Tsai, W.C. & Lloyd, R.E. (2014) Cytoplasmic RNA granules, & viral infection. Annu. Rev. Virol., 1, 147–170.
28) Onomoto, K., Jogi, M., Yoo, J.S., Narita, R., Morimoto, S., Takemura, A., Sambhara, S., Kawaguchi, A., Osari, S., Nagata, K., et al. (2012) Critical role of an antiviral stress granule containing RIG-I and PKR in viral detection and innate immunity. PLoS One, 7, e43031.
29) Okonski, K.M. & Samuel, C.E. (2013) Stress granule formation induced by measles virus is protein kinase PKR dependent and impaired by RNA adenosine deaminase ADAR1. J. Virol., 87, 756–766.
30) Fung, G., Ng, C.S., Zhang, J., Shi, J., Wong, J., Piesik, P., Han, L., Chu, F., Jagdeo, J., Jan, E., et al. (2013) Production of a dominant-negative fragment due to G3BP1 cleavage contributes to the disruption of mitochondria-associated protective stress granules during CVB3 infection. PLoS One, 8, e79546.
31) Gordon, D.E., Jang, G.M., Bouhaddou, M., Xu, J., Obernier, K., White, K.M., O’Meara, M.J., Rezelj, V.V., Guo, J.Z., Swaney, D.L., et al. (2020) A SARS-CoV-2 protein interaction map reveals targets for drug repurposing. Nature, 583, 459–468.
32) Luo, L., Li, Z., Zhao, T., Ju, X., Ma, P., Jin, B., Zhou, Y., He, S., Huang, J., Xu, X., et al. (2021) SARS-CoV-2 nucleocapsid protein phase separates with G3BPs to disassemble stress granules and facilitate viral production. Sci. Bull. (Beijing), 66, 1194–1204.
33) Zheng, Z.Q., Wang, S.Y., Xu, Z.S., Fu, Y.Z., & Wang, Y.Y. (2021) SARS-CoV-2 nucleocapsid protein impairs stress granule formation to promote viral replication. Cell Discov., 7, 38.
34) Nabeel-Shah, S., Lee, H., Ahmed, N., Burke, G.L., Farhangmehr, S., Ashraf, K., Pu, S., Braunschweig, U., Zhong, G., Wei, H., et al. (2022) SARS-CoV-2 nucleocapsid protein binds host mRNAs and attenuates stress granules to impair host stress response. iScience, 25, 103562.
35) Reuper, H., Amari, K., & Krenz, B. (2021) Analyzing the G3BP-like gene family of Arabidopsis thaliana in early turnip mosaic virus infection. Sci. Rep., 11, 2187.
36) Abulfaraj, A.A., Mariappan, K., Bigeard, J., Manickam, P., Blilou, I., Guo, X., Al-Babili, S., Pflieger, D., Hirt, H., & Rayapuram, N. (2018) The Arabidopsis homolog of human G3BP1 is a key regulator of stomatal and apoplastic immunity. Life Sci. Alliance, 1, e201800046.
37) Krapp, S., Greiner, E., Amin, B., Sonnewald, U., & Krenz, B. (2017) The stress granule component G3BP is a novel interaction partner for the nuclear shuttle proteins of the nanovirus pea necrotic yellow dwarf virus and geminivirus abutilon mosaic virus. Virus Res., 227, 6–14.
38) Reuper, H. & Krenz, B. (2021) Comparison of two Turnip mosaic virus P1 proteins in their ability to co-localize with the Arabidopsis thaliana G3BP-2 protein. Virus Genes, 57, 233–237.
39) Sami-Subbu, R., Choi, S.B., Wu, Y., Wang, C., & Okita, T.W. (2001) Identification of a cytoskeleton-associated 120 kDa RNA-binding protein in developing rice seeds. Plant Mol. Biol., 46, 79–88.
40) Davies, E., Fillingham, B.D., Oto, Y., & Abe, S. (1991) Evidence for the existence of cytoskeleton-bound polysomes in plants. Cell Biol. Int. Rep., 15, 973–981.
41) Davies, E., Comer, E.C., Lionberger, J.M., Stankovic, B., & Abe, S. (1993) Cytoskeleton-bound polysomes in plants. III. Polysome-cytoskeleton-membrane interactions in corn endosperm. Cell Biol. Int., 17, 331–340.
42) Muench, D.G., Wu, Y., Coughlan, S.J., & Okita, T.W. (1998) Evidence for a Cytoskeleton-Associated Binding Site Involved in Prolamine mRNA Localization to the Protein Bodies in Rice Endosperm Tissue. Plant Physiol., 116, 559–569.
43) Wang, C., Washida, H., Crofts, A.J., Hamada, S., Katsube-Tanaka, T., Kim, D., Choi, S.B., Modi, M., Singh, S., & Okita, T.W. (2008) The cytoplasmic-localized, cytoskeletal-associated RNA binding protein OsTudor-SN: evidence for an essential role in storage protein RNA transport and localization. Plant J., 55, 443–454.
44) Sundström, J.F., Vaculova, A., Smertenko, A.P., Savenkov, E.I., Golovko, A., Minina, E., Tiwari, B.S., Rodriguez-Nieto, S., Zamyatnin, A.A. Jr., Välineva, T., et al. (2009) Tudor staphylococcal nuclease is an evolutionarily conserved component of the programmed cell death degradome. Nat. Cell Biol., 11, 1347–1354.
45) dit Frey, N.F., Muller, P., Jammes, F., Kizis, D., Leung, J., Perrot-Rechenmann, C., & Bianchi, M.W. (2010) The RNA Binding Protein Tudor-SN Is Essential for Stress Tolerance and Stabilizes Levels of Stress-Responsive mRNAs Encoding Secreted Proteins in Arabidopsis. Plant Cell, 22, 1575–1591.
46) Anderson, P. & Kedersha, N. (2006) RNA granules. J. Cell Biol., 172, 803–808.
47) Kedersha, N., Cho, M.R., Li, W., Yacono, P.W., Chen, S., Gilks, N., Golan, D.E., & Anderson, P. (2000) Dynamic shuttling of TIA-1 accompanies the recruitment of mRNA to mammalian stress granules. J. Cell Biol., 151, 1257–1268.
48) Kirschner, M., Winkelhaus, S., Rg, J.È., Thierfelder, M., & Nover, L. (2000) Transient expression and heat-stress-induced co-aggregation of endogenous and heterologous small heat-stress proteins in tobacco protoplasts. Plant J., 3, 397–411.
49) McLoughlin, F., Kim, M., Marshall, R.S., Vierstra, R.D., & Vierling, E. (2019) HSP101 interacts with the proteasome and promotes the clearance of ubiquitylated protein aggregates. Plant Physiol., 180, 1829–1847.
50) Fernández-Bautista, N., Fernández-Calvino, L., Muñoz, A., Toribio, R., Mock, H.P., & Castellano, M.M. (2018) HOP family plays a major role in long-term acquired thermotolerance in Arabidopsis. Plant Cell Environ., 41, 1852–1869.
51) Jan, A., Maruyama, K., Todaka, D., Kidokoro, S., Abo, M., Yoshimura, E., Shinozaki, K., Nakashima, K., & Yamaguchi-Shinozaki, K. (2013) OsTZF1, a CCCH-tandem zinc finger protein, confers delayed senescence and stress tolerance in rice by regulating stress-related genes. Plant Physiol., 161, 1202–1216.
52) Koguchi, M., Yamasaki, K., Hirano, T., & Sato, M.H. (2017) Vascular plant one-zinc-finger protein 2 is localized both to the nucleus and stress granules under heat stress in Arabidopsis. Plant Signal. Behav., 12, e1295907.
53) Lin, P.C., Pomeranz, M.C., Jikumaru, Y., Kang, S.G., Hah, C., Fujioka, S., Kamiya, Y., & Jang, J.C. (2011) The Arabidopsis tandem zinc finger protein AtTZF1 affects ABA- and GA-mediated growth, stress and gene expression responses. Plant J., 65, 253–268.
54) Qu, J., Kang, S.G., Wang, W., Musier-Forsyth, K., & Jang, J.C. (2014) The Arabidopsis thaliana tandem zinc finger 1 (AtTZF1) protein in RNA binding and decay. Plant J., 78, 452–467.
55) Mitsuda, N., Hisabori, T., Takeyasu, K., & Sato, M.H. (2004) VOZ; isolation and characterization of novel vascular plant transcription factors with a one-zinc finger from Arabidopsis thaliana. Plant Cell Physiol., 45, 845–854.
56) Yasui, Y., Mukougawa, K., Uemoto, M., Yokofuji, A., Suzuri, R., Nishitani, A., & Kohchia, T. (2012). 24, 3248–3263.
57) Kumar, S., Choudhary, P., Gupta, M., & Nath, U. (2018) VASCULAR PLANT ONE-ZINC FINGER1 (VOZ1) and VOZ2 Interact with CONSTANS and promote photoperiodic flowering transition. Plant Physiol., 176, 2917–2930.
58) Song, C., Lee, J., Kim, T., Hong, J.C., & Lim, C.O. (2018) VOZ1, a transcriptional repressor of DREB2C, mediates heat stress responses in Arabidopsis. Planta, 247, 1439–1448.
59) Nakai, Y., Nakahira, Y., Sumida, H., Takebayashi, K., Nagasawa, Y., Yamasaki, K., Akiyama, M., Ohme-Takagi, M., Fujiwara, S., Shiina, T., et al. (2013) Vascular plant one-zinc-finger protein 1/2 transcription factors regulate abiotic and biotic stress responses in Arabidopsis. Plant J., 73, 761–775.
60) Nakai, Y., Fujiwara, S., Kubo, Y., & Sato, M.H. (2013) Overexpression of VOZ2 confers biotic stress tolerance but decreases abiotic stress resistance in Arabidopsis. Plant Signal. Behav., 8, e23358.
61) Bhasin, H. & Hülskamp, M. (2017) ANGUSTIFOLIA, a Plant Homolog of CtBP/BARS Localizes to Stress Granules and Regulates Their Formation. Front. Plant Sci., 8, 1004.
62) Hamada, T., Yako, M., Minegishi, M., Sato, M., Kamei, Y., Yanagawa, Y., Toyooka, K., Watanabe, Y., & Hara-Nishimura, I. (2018) Stress granule formation is induced by a threshold temperature rather than a temperature difference in Arabidopsis. J. Cell Sci., 131, jcs216051.
63) Kedersha, N., Stoecklin, G., Ayodele, M., Yacono, P., Lykke-Andersen, J., Fritzler, M.J., Scheuner, D., Kaufman, R.J., Golan, D.E., & Anderson, P. (2005) Stress granules and processing bodies are dynamically linked sites of mRNP remodeling. J. Cell Biol., 169, 871–884.
64) Buchan, J.R., Muhlrad, D., & Parker, R. (2008) P bodies promote stress granule assembly in Saccharomyces cerevisiae. J. Cell Biol., 183, 441–455.
65) Motomura, K., Le, Q.T.N., Hamada, T., Kutsuna, N., Mano, S., Nishimura, M., & Watanabe, Y. (2015) Diffuse decapping enzyme DCP2 accumulates in DCP1 foci under heat stress in Arabidopsis thaliana. Plant Cell Physiol., 56, 107–115.
著者紹介Author Profile
 濱田 隆宏(はまだ たかひろ)
濱田 隆宏(はまだ たかひろ)岡山理科大学生命科学部准教授.博士(理学).
略歴2007年兵庫県立大学大学院生命理学研究科修了,同年奈良先端科学技術大学院大学GCOE研究員,10年マサチューセッツ大学アマースト校ポスドク,11年京都大学大学院理学研究科学振PD, 13年東京大学大学院総合文化研究科助教,18年からJSTさきがけ研究者,19年から現職.
研究テーマと抱負植物微小管の制御メカニズムと微小管ネットワークの役割に興味を持っている.現在の研究は微小管上で形成されるコンデンセートの役割や,細胞外小胞による細胞間コミュニケーションの可能性を探っている.
ウェブサイトhttp://hamada-lab.main.jp
趣味アウトドア,お酒,フットサル.