化学シナプスの情報伝達はシナプス前終末から開口放出された伝達物質がシナプス後膜上に存在する受容体に結合することで進行する.この一連のイベントにはシナプス前終末のアクティブゾーンやシナプス後膜直下のシナプス後膜肥厚(postsynaptic density:PSD)のタンパク質集合体およびそれらの離合集散や翻訳後修飾が関与しており,生化学的・細胞生物学的な研究が盛んに行われてきた.しかしながら,あまりにも多くのタンパク質が関与しているため全貌の解明にはまだほど遠く,これらのタンパク質の動態を一元的に理解するロジックが求められていた.
液–液相分離は細胞内に安定かつ環境応答性に富む生体分子の動的集合体(コンデンセート)を形成する機構として脚光を浴びている.このようなコンデンセートは主にmRNAやタンパク質から構成され,いわゆる膜のないオルガネラとして細胞質から区画化されている.コンデンセートの役割は,化学反応の促進・阻害,局在制御,メカノセンシング・メカノレスポンス,脂質二重膜の曲率制御など多岐にわたる1)が,いずれにしてもその安定かつ動的という特徴を活かした役割を担っており,そのユニークな研究の数々は相分離生物学という新しい分野を開拓している.液–液相分離の流行の波は神経科学にも押し寄せており,極性の高い細胞である神経細胞では特に重要な役割を果たしていることがわかってきている2).シナプスにおいても液–液相分離の考え方をシナプスタンパク質の集合体に導入することでこれまでの文脈では理解しきれなかった構造体や現象が次々と説明できるようになり,シナプス伝達および可塑性の理解が急速に進んでいる(図1).本稿ではその最新の動向をシナプス前終末とPSDに分けて,筆者の最近の仕事とともにご紹介したい.
シナプシンはプロテインキナーゼAによりリン酸化される因子として同定された,シナプス前終末に局在する非膜貫通型のシナプス小胞結合タンパク質である3).ノックアウトマウスによる解析からシナプス小胞を予備プールとして安定化する役割が示唆されており,シナプス活動依存的なリン酸化によりシナプス小胞への結合が減少し開口放出が促進されると考えられている4).しかしながら,シナプシンがシナプス前終末内で実際にどのようにシナプス小胞を安定化しているのかは明らかではなかった.
2018年,精製シナプシンが生理的バッファー内においてコンデンセートを形成することが報告された5)(図1A).このコンデンセートは液–液相分離に一般的に共通する以下の要素を満たしていた.①球体である.これは動的な構造体が表面張力を最小化しようとするためである.②蛍光退色からの回復を示す.これは構成分子が構造体内部で常に混ざっており,かつ構造体内外でも入れ替わりが起きているためである.③コンデンセートどうしが融合する.これはたとえばラーメンに浮かぶ油滴どうしが融合するのと同じである.また,排除体積効果により分子凝縮を促進するポリエチレングリコールによりコンデンセート形成の促進がみられることや,全アミノ配列の40%近くに及ぶC末端領域が液–液相分離を起こしやすいタンパク質の特徴である天然変性領域であることから,論文筆者らは精製シナプシンが生理的バッファー内において液–液相分離により液体としての性質を持つコンデンセートを形成したと結論づけている.そこにシナプス小胞を模してdioleoyl phosphatidylethanolamine(DOPE)で構成したリポソームを混合すると,シナプシンとリポソームは均質に共局在するコンデンセートを形成した.また電子顕微鏡による解析では,カバーガラス上のリポソームの分布は単体では分散的だがシナプシンの存在下ではクラスター化していた.これらのことから,シナプス小胞がシナプス前終末で拡散を免れ安定化し予備プールとして存在する機構には,シナプシンの液–液相分離によるコンデンセート形成が関与している可能性が示唆された.さらに論文筆者らはリン酸化による影響も検証している.シナプス活動に関与するカルシウムカルモデュリン依存性タンパク質キナーゼII(CaMKII)により天然変性領域がリン酸化されることでシナプシンおよびシナプシン:リポソームの形成するコンデンセートが離散することを明らかにした.このことは,従来のモデルであるリン酸化による予備プールの離散と開口放出の促進と一致している.
シナプス小胞には予備プールの他に刺激が到達した際に直ちに放出可能な放出可能プールが存在するが,実はこちらにも液–液相分離が関与している.RIMタンパク質はシナプス前終末アクティブゾーンの足場タンパク質として働き,さまざまなタンパク質と相互作用しながらシナプス小胞の放出可能プールを形成し開口放出を制御していると考えられている6).2019年に,RIMタンパク質と電位依存性カルシウムチャネル(voltage-gated calcium channel:VGCC)の細胞内ドメインが,RIM結合タンパク質(RIM–BP)を介して液–液相分離によるコンデンセートを形成することが報告された7)(図1B).このコンデンセートも前に述べた液–液相分離に一般的に共通する三つの要素を満たし,また結合の競合阻害を行うことで離散することから,液体としての性質を持っているといえる.論文筆者らはガラス基板上に脂質二重膜を再現したsupported lipid bilayerを用いて膜タンパク質であるVGCCの細胞内ドメインによる局在制御を擬似的に再現しているが,拡散していたタンパク質がRIMおよびRIM–BPの添加によりクラスター化するようすを観察することに成功している.これらのことは,VGCCを含むアクティブゾーンタンパク質が液–液相分離によりクラスター化している可能性を示唆している.
ここまでで,予備プールと放出可能プールがそれぞれ液–液相分離により制御されている可能性がみえてきた.では,これら二つの関係はどうなっているのだろうか.2020年,RIMの液–液相分離を報告したグループはさらに,シナプシン:リポソームの実験とRIM:RIM–BP:VGCC:形質膜の実験を組み合わせ,これら二つのコンデンセートの関係性に関する論文を出している8).コンデンセートどうしがどのように干渉しあうかについてはさまざまなパターンがあり,独立して存在する場合,融合し混ざりあう場合,混ざらず接着する場合,片方が他方を内包しつつ混ざらない区画を形成する場合などが知られている9).この実験では印象深いことに,形質膜を模したgiant unilamellar vesicle(GUV)上にRIMを中心としたコンデンセートが形成され,そこに覆いかぶさるようにシナプシン-リポソームのコンデンセートが形成され,混ざらないコア-シェル型の区画として安定した.もちろんこれはin vitroの実験ではあるが,このことは予備プールと放出可能プールが同一コンデンセート内の区画として存在する可能性を示唆している.これらの研究をさらに進めることで,予備プールから開口放出までの一連の流れをシームレスに理解することができると期待される.
電子顕微鏡画像においてシナプス後膜直下の細胞質側に電子密度の高い領域が存在することは1950年代から知られていた10).のちにPSDと名づけられたこの構造体は,シナプス膜に接してはいるが膜で囲まれてはおらず,界面活性剤に不溶である性質を利用し単離され,数百種類に及ぶさまざまなタンパク質の約1 GDaにもなる巨大な集合体であることが明らかとなった11)(図1C).界面活性剤に不溶なタンパク質の集合体といえばアルツハイマー病やパーキンソン病などの神経変性疾患でみられる凝集体を連想するが,PSDは正常な神経細胞のシナプスに普遍的に観察され,伝達物質受容体の局在制御など生理的な機能を担っている.1999年,光退色後蛍光回復法(fluorescence recovery after photobleaching:FRAP)の実験によりPSDが動的な構造体であることが報告された12).タンパク質によって蛍光の回復の速度に違いがあり,また同じタンパク質でも早い成分と遅い成分があることが明らかとなったが,この事実は一般的にPSDタンパク質分子が細胞質など他の領域のタンパク質と常時入れ替わっていることを示唆している.このダイナミクスはシナプス伝達や可塑性に重大な意義を持っていると考えられるが,界面活性剤に不溶なほど強固な構造体であるPSDがいかにして数百種類にも及ぶタンパク質の離合集散を伴うダイナミクスを維持しているのかは不明だった.
2016年,PSDの足場タンパク質PSD-95とPSDに局在するRasGAPであるSynGAPが精製系において液–液相分離によりコンデンセートを形成することが報告された13).一般的なコンデンセートが主に天然変性領域による疎水性結合やmRNAとの結合を利用するのに対して,このコンデンセートはタンパク質のホモまたはヘテロの比較的弱い相互作用(Kd=数百nM~数μM)で形成されている.SynGAPがそのコイルドコイル領域を用いて三量体を形成し,PSD-95と多価の結合をすることで液体としての性質を持ったコンデンセートが形成される.すなわちPSDの形成過程には液–液相分離が関与しており,PSDの正体がコンデンセートである可能性が示唆された.安定かつ動的という液–液相分離の特徴は,これまで実際に観察されてきたPSDの特徴を見事に説明している.
さらに2018年,同じ論文筆者らはこのPSD-95-SynGAPのコンデンセートにさらにHomer, Shank, GKAPといった足場タンパク質やNMDA型グルタミン酸受容体(NMDA受容体)サブユニットGluN2BのPDZドメイン結合モチーフといった主要なPSDタンパク質を加え,液–液相分離により計6種類のタンパク質が均質に混ざったコンデンセートが形成されることを明らかにした14).こちらも同様に各要素のオリゴマー化を中心とした多価の結合がコンデンセート形成の原動力になっている.論文筆者らはこれを再構成PSDと呼び,受容体の動態や可塑性の研究に有用なメソッドになると述べている.本論文ではコンデンセート内部のそれぞれのタンパク質濃度にも言及されており,コンデンセート内部では分散して存在する場合のタンパク質濃度の数十から数百倍に濃縮されていた.また要素を引き算していく解析によってどのタンパク質が液–液相分離に重要なのかを解析し,PSD-95, GKAP, Homer, Shankを液–液相分離を誘導するドライバーとし,SynGAPをコンデンセートに参加するだけのクライアントとしている.さらに重要なことに,このコンデンセートを離散させる因子としてHomer1aを同定している.Homer1aはHomer1遺伝子のスプライスバリアントとして発現する内在性因子だが,ホモ四量体形成に必要なコイルドコイル領域を欠くため単量体として存在している.このHomer1aを再構成PSDに添加したところ,PSDタンパク質が離散しコンデンセートが消失した.これは本来ホモ四量体として多価の結合により液–液相分離の原動力となっているHomerが単量体のHomer1aにより結合を競合阻害されることが主な原因だと考えられるが,詳しくはさらなる研究が期待される.また,Homer1aは睡眠時のシナプス抑圧に関与しているという報告があり15),本論文におけるPSDの離散と一致している.
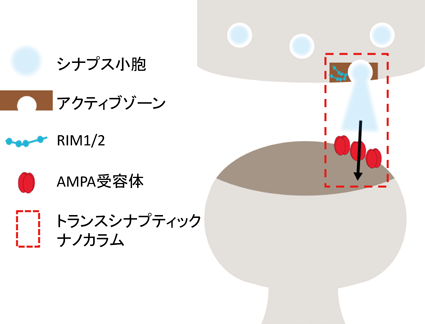
シナプス後膜上にはAMPA型グルタミン酸受容体(AMPA受容体)やNMDA受容体などの膜タンパク質が局在している.PSDはこの受容体群の足場として機能してそのシナプス膜上での量を規定していると考えられてきたが,近年の超高解像顕微鏡技術の発達によりまた別の役割も担っていることがわかってきた.2013年に複数の超高解像顕微鏡法を用いて海馬の培養神経細胞におけるAMPA受容体のPSD内部のナノスケール局在を観察した研究では,一つのシナプスに存在するAMPA受容体の数の65%はナノドメインと呼ばれる集合体として存在し,またそのようなナノドメインを持つシナプスは全体の80%以上であった16).2016年には,PSD-95もまたPSD内部でクラスター化しAMPA受容体とナノドメインとして共局在していること,またこのナノドメインはシナプス前終末のRIMのコンデンセートのナノスケール局在とアライメントされていることが報告された17)(図2).論文筆者らはこのような構造体をトランスシナプティックナノカラムと呼んでおり,伝達物質が開口放出される位置とナノドメインの位置をアライメントすることでシナプスの情報伝達効率を上げるための仕組みであろうと考えられる.重要なことに,これらの研究ではナノドメインとナノカラムが興奮性刺激依存的に形成されることもまた示唆されている.すなわち,ナノドメインおよびナノカラムの形成によるシナプス伝達の効率化は,学習の基盤としてのシナプス可塑性を説明する分子的基盤となりうるのである.
では興奮性刺激はどのようにしてナノドメインやナノカラムの形成を導くのだろうか.興奮性刺激によりシナプス後膜上のNMDA受容体が活性化すると細胞内にカルシウムイオンが流入する.このカルシウムイオンの流入はごく一過的なものであり,チャネル近傍の空間で10 μM程度の濃度の上昇が起こったのちに1 msecほどで拡散してしまう18)が,チャネル直下に存在するPSDには大きな影響を及ぼすと考えられる.そのような影響の中で最もよく研究されているのがCaMKIIの活性化である19).CaMKIIはPSDの主成分で神経細胞全体の2%を占める高発現な12量体のタンパク質であり,カルシウムカルモデュリンと結合することで立体構造が変化し酵素として活性化する.CaMKIIのユニークな特徴の一つにThr286(αサブユニット)またはThr287(β, γ, δサブユニット)の自己リン酸化があげられる.自己リン酸化されたCaMKIIはその立体構造が固定され,カルシウム濃度が下がりカルモデュリンが解離した後にも活性化立体構造を維持し続ける.これはシナプス活動によるカルシウム流入という一過性の情報を自らの立体構造の変化という情報に固定する役割をCaMKIIが担っていることを意味しており,シナプス可塑性へ重大な貢献を果たしていると考えられる.しかしながら酵素は一般的に高発現である必要はなく,また12量体を形成する必然性もわかっておらず,酵素以外の役割を果たしている可能性が指摘されていた.
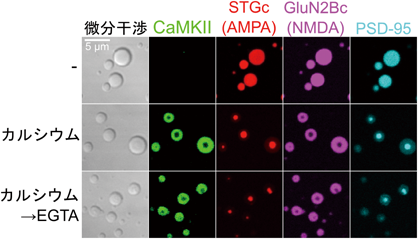
筆者らはこれらの背景から,12量体のCaMKIIが立体構造変化によりPSDタンパク質と多価の結合をして液–液相分離によるコンデンセートを形成する可能性に着想した.そこで生理的バッファー条件下で精製CaMKII,精製カルモデュリン,また活性型CaMKIIと結合することが知られているNMDA受容体サブユニットGluN2Bの細胞内ドメイン(GluN2Bc)を混合し,顕微鏡観察を行った.混合した状態ではコンデンセートはみられなかったが,カルシウムを添加するとCaMKIIとGluN2Bcが均質に混ざったコンデンセートが観察された20).このコンデンセートはさらにEGTAを添加するとタンパク質が離散し消失したことから,CaMKIIの立体構造依存的にコンデンセートが形成・維持されることを示唆している.そこでCaMKIIの自己リン酸化を誘導するためMg2+-ATPを加えて同様の実験を行ったところ,同様にカルシウム添加によりコンデンセートが形成されたが,さらにEGTAを加えてもタンパク質が離散せずコンデンセートが維持された.このことは,シナプス活動によるカルシウム流入という一過性の情報が,自己リン酸化による立体構造の維持を介して安定かつ動的な構造体であるコンデンセートに変換されたことを意味する.
このコンデンセートは前述の球体・蛍光退色からの回復・融合の条件を満たしており,液体としての性質を持つと確認できた.次にコンデンセートの形成と維持のメカニズムを詳細に調べるため変異体による解析を行った.CaMKIIの自己会合ドメインを除いたCaMKII1-314単量体変異体およびGluN2Bcと結合しない変異体はコンデンセートを形成しなかった.このことは,GluN2Bcとの多価の結合がコンデンセート形成のトリガーであることを示唆している.一方で酵素活性のないK42R変異体や自己リン酸化されないT286A変異体は,コンデンセートを形成するもののMg2+-ATP存在下にもかかわらずEGTAにより離散し消失した.このことは,自己リン酸化がコンデンセートのカルシウム濃度への非依存性の獲得に必須であることを示唆している.
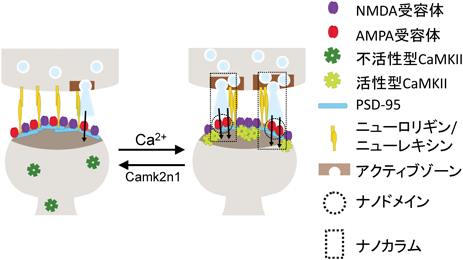
ではこの可塑的なコンデンセートの形成はPSD全体,特にAMPA受容体の局在にどのような影響をもたらすだろうか.そこでAMPA受容体の補助サブユニットでありPSD-95と結合するstargazinの細胞内ドメイン(STGc),PSD-95をさらに加えて実験を行った.カルシウム添加前ではPSD-95とSTGcとGluN2Bcの三者がそれぞれ均質に混ざったコンデンセートを形成した(図3).これはカルシウムに依存しない液–液相分離によるものであり,過去の報告と一致している.そこにカルシウムを添加すると活性化したCaMKIIがGluN2Bcと結合することでコンデンセートに取り込まれた.ところが興味深いことに,この四者のコンデンセートは均質に混ざっておらず,明瞭な境界によりコア-シェル型に区画化された二相構造を持つ構造体として安定した(図3中段).外液である希薄相も含めれば環境が三相に区画化されたことになる.コアの構成成分はSTGc:PSD-95で,シェルの構成成分はCaMKII:GluN2Bcで決まっており,少なくとも今回の観察条件ではコアとシェルが逆になったようなコンデンセートは観察されなかった.この構造体を三次元的に観察すると,カバーガラス上に貼りついたCaMKII:GluN2Bcのドーム状のコンデンセートでSTGc:PSD-95のコンデンセートがすっぽり包み込まれており,いちご大福のような構造をしている.このようなコンデンセート内部でのSTGc-PSD-95の区画化は実際のシナプスで観察されるPSD内部でのAMPA受容体-PSD-95のナノドメインの形成と酷似しており,コンデンセートどうしの区画化がナノドメインの形成過程であると期待できる.
ではナノドメインがシナプス前終末と連携してナノカラムを形成する機構は何であろうか.シナプス前終末とシナプス後膜の間のシナプス間隙には細胞接着因子が存在しており,この接着因子はシナプスの形成に関与していると考えられているが,それだけではなくその物理的な接触を介して順行性もしくは逆行性に情報交換を行うシステムがあると考えられている.シナプス後膜側の接着因子であるニューロリギン(neuroligin)は細胞内ドメインでPSD-95と結合し,細胞外ドメインでニューレキシン(neurexin)と結合する.ニューレキシンはシナプス前終末の接着因子であり,細胞外ドメインでニューロリギンと結合し,細胞内ドメインでは前終末側の足場タンパク質と結合しシナプス小胞の開口放出に関与している.そのためニューロリギンは逆行性シグナル伝達としてPSDの情報をシナプス小胞に伝えるシステムとして機能する21).そこで4種のタンパク質が区画化されたコンデンセートにさらにニューロリギンを混合した.ニューロリギンはPSD-95に結合することから,結果として予想どおりニューロリギンはSTGc:PSD-95により構成されるコアのコンデンセートに集積した.このことは,ニューロリギンがAMPA受容体のナノドメインの位置を逆行性シグナルとして伝達することを示唆している.
ここまでで精製タンパク質系を用いて,再構成PSDが興奮性刺激により可塑的に複雑化(二相化)し,それがシナプス伝達効率に関わる可能性を見いだしてきた(図4).しかしシナプス可塑性には増強と抑圧の二方向性制御が存在することが知られており,カルシウムに依存しない再構成PSDがHomer1aで離散するようにカルシウムによりトリガーされるCaMKIIの主導するコンデンセートにも離散機構が存在するはずである.脳に高発現する78アミノ酸の小さなタンパク質Camk2n1は機能未知だがCaMKIIと結合することが知られている.重要なことにCaMKIIのCamk2n1との結合インターフェイスはGluN2Bcとのそれと同じであるため,結合の競合阻害が起きると予想される.そこでCaMKII:GluN2BcのコンデンセートにCamk2n1をインジェクションしたところ,コンデンセートの離散が観察された.さらにコア-シェル二相構造を形成している状態のコンデンセートにCamk2n1をインジェクションしたところ,シェル構造のみが離散しコア構造が剥き出しになる現象が観察された.これはコンデンセートを維持する原動力であるCaMKII-GluN2Bcの多価の結合が単量体であるCamk2n1により競合阻害された結果であると考えられる.このことは,興奮性刺激により可塑的に形成されシナプス伝達効率の向上に関与していると考えられるコンデンセートがCamk2n1により離散し,シナプス伝達効率を低下させている可能性を示唆している.このように,液–液相分離により形成されるコンデンセートは,環境が変化しなければ安定であるが,その離合集散は制御可能であり,学習や睡眠等のイベントでシナプス伝達をすばやく調節する必要のあるシナプス可塑性には理想的なシステムといえよう.
分子とオルガネラの中間に位置する分子集合体という存在はこれまで見過ごされてきたが,相分離生物学の発展によりその研究領域の入り口が開かれた.最近ではさまざまな種類の細胞でユニークな役割を担う分子集団が次々と発見されており,まさに破竹の勢いで研究領域の開拓が進んでいる.本稿ではシナプスに注目し,液–液相分離コンデンセートの存在,役割,内部区画化,離合集散の制御に関する報告を振り返った.思えばシナプス伝達およびシナプス可塑性を調節するシステムとして液–液相分離は理想的であり,驚くべきことではないのかもしれないが,それでもタンパク質の集合だけでこのような複雑で合理的な制御が行われうる事実には驚嘆を禁じえない.相分離生物学は今後もますます重要な研究領域となっていくことに間違いはないが,具体的にどのような課題があるだろうか.一つは細胞内における新たなコンデンセートと新たな役割の同定であろう.コンデンセートのサイズは種類によって大きく異なり,数十μmになる場合もあれば数百nmに満たない場合もある.特に小さなコンデンセートをどう発見しどう解析するかが課題になってくるだろう.次の課題は離合集散のメカニズムである.離合集散の必要十分条件,速度などをin vitro, in cellの双方で理解する必要があり,特に細胞内での観察手法の多角化が求められる.またコンデンセートの物性,内部構造やコンポーネントの解析も課題としてあげられる.「濡れやすさ」,粘度,表面張力,内部のタンパク質濃度,内部の濃度勾配や区画化の有無,参加している・参加しうるタンパク質の種類など,解析するべきファクターは無数にある.これらを簡便かつ正確に明らかにしていく技術的な発展が期待される.