1. はじめに—神経細胞におけるRNA顆粒と翻訳制御
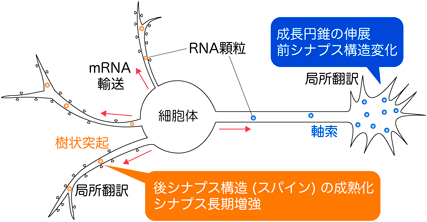
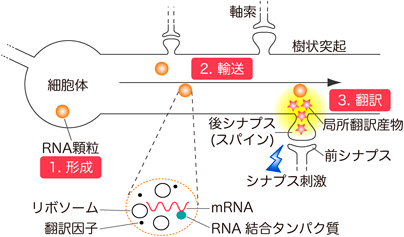
極性を持つ細胞において,mRNAの局在化とそれに伴う翻訳の制御は,その細胞特有の機能を発揮するために必要不可欠である.長い突起を持つ神経細胞も例外ではなく,細胞体に加えて樹状突起や軸索の神経突起にもmRNAが局在化し,局所的に翻訳が起こることが知られている1, 2).「局所翻訳」と呼ばれるこの制御は,神経特有の形態や機能を生み出す.たとえば軸索末端における局所翻訳は,成長円錐の伸展や前シナプスの構造変化をもたらし3, 4),また樹状突起における局所翻訳は,後シナプス構造であるスパインの成熟化やシナプス長期増強,ひいては長期記憶形成に必須である5–7)(図1).特に後者の樹状突起においては,「RNA顆粒」と呼ばれる,膜で囲まれていないオルガネラ(非膜オルガネラ)が,mRNA局在化および局所翻訳制御の鍵となることが近年明らかにされてきた.本稿では,主に樹状突起における局所翻訳に焦点を当て,RNA顆粒がいかにしてこれらの制御に関与するのかを,神経RNA顆粒の形成(2.1節),輸送(2.2節),翻訳制御(2.3節)の3ステップに分けて概説する(図2).さらに,RNA顆粒と長期記憶形成との関連について考察し(3章),最後にRNA顆粒形成の駆動力となる液–液相分離(liquid–liquid phase separation:LLPS)のイメージング解析・光遺伝学的操作法を紹介する(4章).
1)RNA顆粒の形成とmRNAの取り込み
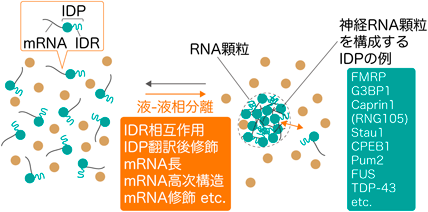
RNA顆粒は,mRNA,リボソーム,RNA結合タンパク質等が凝縮した非膜オルガネラである.神経RNA顆粒に含まれるRNA結合タンパク質は多種にわたり,fragile X mental retardation protein(FMRP),GTPase activating protein SH3 domain binding protein 1(G3BP1),cell cycle associated protein 1(Caprin1,別名RNG105),staufen double-stranded RNA binding protein 1(Stau1),cytoplasmic polyadenylation element binding protein 1(CPEB1),pumilio RNA-binding family member 2(Pum2),fused in sarcoma(FUS),TAR DNA binding protein(Tardbp,別名TDP-43)等が知られている8, 9).これらは三次元構造をとらない天然変性領域(intrinsically disordered region: IDR)を持つ天然変性タンパク質(intrinsically disordered protein: IDP)であり,これらIDPどうしのIDRを介した多価で弱い結合がLLPSの駆動力となり,凝縮体(コンデンセート)形成を引き起こす(図3).IDRによるLLPSは,翻訳後修飾によって制御されるケースが報告されている.たとえば,FMRPのIDRのリン酸化はLLPSを促進し,逆にメチル化はLLPSを抑制する10).FMRPとCaprin1のIDRどうしが相互作用してLLPSを起こすか否かも,各IDRのリン酸化状態に依存する11).また,IDPは特定のmRNAと相互作用してRNA顆粒内部にmRNAを取り込むが,mRNAそのものもまた,IDPとの相互作用によりLLPSを駆動する要素であり,コンデンセート形成を制御することが知られている12, 13).mRNAの二次構造がLLPSのダイナミクスを変化させるという報告や14),mRNA上の複数か所のm6A修飾がLLPSを促進するという報告もある15).このように,LLPSの駆動力となるIDRやmRNAの相互作用は,さまざまな方法で制御される(図3).RNA顆粒は膜を持たないコンデンセートであり,それゆえに凝縮と離散のダイナミックな動態を示すが,そのダイナミクスが制御されるという特徴が,後述する局所翻訳のON/OFF制御の鍵になると考えられる.
シナプス近傍における局所翻訳を起こすためには,RNA顆粒によってmRNAが樹状突起へ輸送されることが不可欠である(図2).では,どのような種類のmRNAが選択的にRNA顆粒に取り込まれるのだろうか.この問いを解明するための第一の方法として,RNA顆粒構成因子のIDPと相互作用するmRNAの同定があげられる.これまでに多くの報告が蓄積されてきたが,それらは非体系的な知見として散在していたため,神経RNA顆粒構成因子のうち主要なIDPと相互作用するmRNA群をカタログ化した16).詳しくはそちらを参照されたいが,一例をあげると,樹状突起に輸送されてシナプス長期増強および記憶形成に関与することがよく知られているcalcium/calmodulin-dependent protein kinase II alpha(Camk2a)mRNAは,FMRP, Caprin1, CPEB1, Stau1, Stau2など複数のRNA顆粒構成IDPと相互作用することが明らかにされている17–21).しかしながら,溶液中で同定されたタンパク質–mRNAの結合特異性は,そのmRNAがRNA顆粒に取り込まれる特異性とは必ずしも一致しない22).さらに,タンパク質–mRNAの結合特異性は,LLPSを起こすと変化することも示された23).ゆえに,RNA顆粒によって樹状突起に輸送されるmRNAの同定において,IDPとの結合に着目した従来の方法に代わる新たなアプローチが必要であることがわかってきた.
その新規手法の一つとして,樹状突起を解剖学的に単離し,そこに局在するmRNAを網羅的に同定する方法があげられる24–26).ラットやマウスの海馬には樹状突起が密集した放線状層と呼ばれる領域が存在し,その領域がよく用いられる.この方法を用いた複数の報告では,Camk2a mRNA等,上記方法を用いた際と共通のmRNAが同定された一方,上記の同定結果には含まれないmRNAも多数同定された24–26).この樹状突起単離法を用いた複数の報告を統合すると,樹状突起局在性mRNAは,“シナプス”,“スパイン”,“グルタミン酸受容体”,“リボソーム”,“翻訳伸長因子”の遺伝子オントロジーカテゴリーに分類されるものが有意に多いことがわかってきた16).このことは樹状突起における局所翻訳がシナプス長期増強をもたらす5)という知見とよく一致する.また,同方法を用いることにより,選択的スプライシングバリアントmRNAのうち,3′UTRが長いものほど樹状突起領域に局在化する傾向にあることが示された27).これは,コンデンセートへの取り込まれやすさがmRNAの長さに依存している可能性を示唆しており興味深いが,短いmRNAの中にも樹状突起に局在化するものが一定数報告されている.よって,RNA顆粒に取り込まれるか否かの一要因としてmRNAの長さが示唆される一方で,一次構造のみではなく高次構造や修飾等,その他の要因も排除できない.樹状突起を単離する方法は,輸送されたmRNAを同定できるという大きな利点がある一方で,それらmRNAがRNA顆粒に取り込まれていることは保証されない.この問題点については,近年開発された,細胞内微細構造に局在するmRNAを近接ラベル28)や局所的光照射29)により同定する新手法によって,克服されることが期待される.
細胞体において,IDPやmRNAを含むRNA顆粒がLLPSにより形成されることが,樹状突起における局所翻訳を起こすための一つ目の重要な制御である.そこに取り込まれるmRNAの同定は,RNA顆粒がLLPSによって形成されるがゆえに従来の手法では問題があることがわかってきたが,それを克服する手法が急速に開発されつつある.
2)神経突起へのmRNA輸送
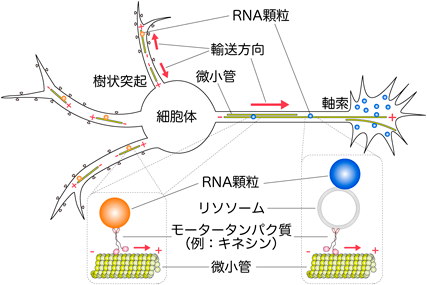
細胞体で形成されたRNA顆粒は,モータータンパク質であるキネシンおよびダイニンによって微小管依存的に神経突起へ輸送される30).軸索では,細胞体側から軸索先端にかけて微小管の配向がマイナス端からプラス端の一方向であり,プラス端へ向かって移動するキネシンが主にRNA顆粒の輸送を担うため,顆粒は遠位方向へ一方向に輸送される(図4)31–33).一方,樹状突起では微小管のプラス端,マイナス端の配向がランダムであり,このためにRNA顆粒は遠位方向にも近位方向にも輸送され,突起全体への配置が可能になる31, 32, 34, 35)(図4).では,膜を持たないRNA顆粒はモータータンパク質とどのように結合するのだろうか.これは,直接的あるいは間接的な相互作用のいずれも報告されている.前者の例としては,RNA顆粒構成IDPであるFMRPがキネシンと相互作用することが示されている(図4左下)36, 37).一方,小胞を介した間接的な相互作用も知られている.RNA顆粒が,軸索ではリソソームに係留され,この小胞にモータータンパク質が結合することで輸送されるという報告がある(図4右下)38).この場合,輸送後に翻訳産物がリソソームの機能とカップルしやすいという利点もあると考えられる.未解明の点も多いが,非膜オルガネラであるRNA顆粒も直接的あるいは間接的にモータータンパク質と相互作用することで,微小管依存的に突起へ輸送されている.さらに輸送後,樹状突起ではシナプス基部周辺にRNA顆粒が係留されることが,局所翻訳後に翻訳産物を目的のシナプスへ供給するには効率的である.これに関しては,FMRPやStaufenがミオシンVaを介してシナプス基部のアクチン繊維に結合することが報告されており9, 39),これらがRNA顆粒の係留を仲介すると考えられる.
次節で述べるように,シナプス入力を受けて初めてRNA顆粒内部のmRNAの翻訳がONになるが,そのためには輸送中および係留中は翻訳が停止した状態が維持される必要がある.では,翻訳はどのようなメカニズムで停止しているのだろうか.RNA顆粒には翻訳開始因子eIF4Eが存在しない一方で,翻訳開始によってmRNAから解離すべきCBP80が存在することから40),顆粒内部では翻訳開始が抑制されていることが示唆されている.一方,樹状突起での翻訳は翻訳開始阻害剤に非感受性であることが報告されており41, 42),この場合は,翻訳開始段階はすでに終了して翻訳伸長段階で停止した状態にあると考えられる.このように相異なるメカニズムが報告されているが,mRNAの種類によって,または,相互作用しているIDPにより,あるいはRNA顆粒ごとに異なる制御で翻訳が停止している可能性も示唆されている40).また,以上のメカニズムとは別に,コンデンセート特有の制御が示唆されている.RNA顆粒は非常に高密度にパッキングされた構造であるため,翻訳開始・伸長因子等が物理的障害によりmRNAにアクセスできず,翻訳が停止しているというものである43).RNA顆粒中で翻訳停止を維持するメカニズムの全容は未解明であるが,このように,RNA顆粒内部で翻訳が抑制された状態でmRNAが樹状突起に輸送されることが,局所翻訳に欠かせない二つ目の制御である.
3)シナプス入力に依存した翻訳スイッチング
樹状突起へ輸送され,シナプス基部に係留されたRNA顆粒はその後,シナプス入力依存的に翻訳がONになる.これが局所翻訳において要となる三つ目の制御である.いかにして輸送・係留中は翻訳OFFを維持し,シナプス入力に応答して翻訳がONになるのだろうか.
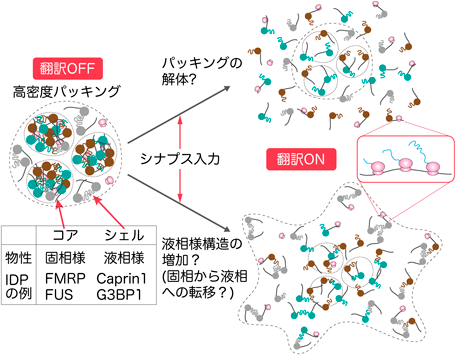
シナプス入力依存的に起こる変化として,翻訳開始・伸長因子のリン酸化を担うmTORやMAPキナーゼの活性化が知られている44).これにより局所翻訳がONになると考えられてきたが,そのためには,これらシグナル伝達分子がRNA顆粒内部の翻訳開始複合体あるいはポリソームにアクセスできなければならない.さらに,mRNA上をリボソームがスライドできるだけの可動性が必要である.これまで,RNA顆粒は高密度にパッキングされた構造であるというのが通説であったため,シナプス入力に応答してこのパッキングが緩むことで構成因子が放出され,翻訳開始因子やリボソーム等がmRNAに相互作用できるようになり,翻訳が顆粒の外部で活性化されると考えられてきた(図5).これらの知見は,単離されたRNA顆粒の電子顕微鏡による観察43)や,IDPの顆粒からの離散18)に根拠を持つ.
しかし近年になり,RNA顆粒内部において翻訳活性がみられることが報告され始めた.Matejuらは,Sun-Tagと呼ばれる新規翻訳可視化法により,神経RNA顆粒と構造的に類似したストレス顆粒の内部で翻訳活性が上昇することを報告した45).顆粒内部で翻訳が起こりうるということは,顆粒の構造は高密度一様ではなく,パッキングが一部緩むような動的な性質を持つことが示唆される(図5).実際にJainらは,ストレス顆粒の構造は均一ではなく,コア様構造とシェル様構造の二相からなることを示している46)(図5).コアは凝縮状態が維持される安定した構造であるのに対し,シェルは離散しやすいダイナミックな動態を示す46).また,Shiinaは複数種類のIDPについて,各IDPが形成する顆粒の動態を詳細に解析し,その結果,FMRPやFUSは固相様のコアの性質を示す顆粒を形成する一方で,Caprin1(RNG105)やG3BP1は液相様のシェルの性質を示す顆粒を形成することを明らかにした47)(図5).さらに,固相様IDPによって形成された顆粒内での翻訳活性は低いが,そこに液相様IDPによって形成されるシェルを共存させることによって,固相様IDPのダイナミクスを上昇させ,それに伴い顆粒内での翻訳活性が上昇することが示されている47).このようなRNA顆粒の構造的不均一性とそれに伴うダイナミクスの多様性が持つ生物学的意義はまだ不明であるが,これらの視点から局所翻訳のON/OFFスイッチング制御のメカニズムに迫ることが可能かもしれない.
局所翻訳の活性化が,RNA顆粒の顆粒構造の解体またはシェル様構造の増加,あるいはさらに別の制御によるのかどうか,その全貌は未解明であるが,では,それらの引き金となるシグナルは何か,という疑問もまた未解明である.LLPSはイオン濃度やpH, ATP濃度,温度変化といった周囲の環境変化に応答して制御されることが知られている46, 48–50).シナプス入力に伴う後シナプス周辺での環境変化,たとえば,Na+やCa2+濃度の上昇にLLPSが影響を受けるとすれば,顆粒のダイナミクスが局所的に変化する可能性が考えられる.局所翻訳がシナプス入力に応答して起こるメカニズムの詳細が,今後,RNA顆粒動態制御の観点から明らかになっていくかもしれない.
記憶はその持続時間から分類すると,数分間続く短期記憶と,数時間,数日,数か月,あるいはそれ以上にわたり維持される長期記憶に分類される.この長期記憶の形成には,シナプスの長期増強が必須であり,さらにその基盤として樹状突起における局所翻訳が重要であることが知られている.上述のように,RNA顆粒による制御が局所翻訳の各ステップに深く関与することが明らかにされてきたが,では,RNA顆粒は長期記憶の形成に実際影響を及ぼすのだろうか.
RNA顆粒によって輸送されるmRNAに注目した研究例として,マウスにおけるCamk2a mRNAに関する報告があげられる.Camk2a mRNAは,3′UTR上に輸送責任cis領域が存在し,その領域を欠損させるとmRNAの樹状突起局在化が低下し,それに伴いシナプス長期増強および長期記憶が低下することが示されている51, 52).しかし,このように特定のmRNAについて樹状突起局在の人為的操作を試みた研究はCamk2aのみにとどまっており,他のmRNAに関する知見の蓄積が求められている.
また,RNA顆粒を構成するIDPに注目した研究も進められている.ショウジョウバエを用いた研究では,Staufen, CPEB, FMRP, Pumilio等の欠損変異体で長期記憶に障害がみられることが示されている.一方,マウスを用いた研究では,RNA顆粒構成因子を欠損させても長期記憶が低下するとは限らない.FMRPをコードするFMRP translational regulator 1(Fmr1)のノックアウトマウスでは,空間学習や恐怖条件づけ学習で長期記憶が低下するという報告と影響を受けないという報告とが混在しており,統一的知見が得られていない53–56).CPEB1やStau1のノックアウトマウスは空間学習や恐怖条件づけ学習において正常な記憶形成能を示し57, 58),G3BP1ノックアウトマウスは作業記憶が低下するものの非空間学習の長期記憶は正常である59).Pum2ノックアウトマウスではむしろ空間学習の記憶が向上する傾向がみられている60).解析している記憶テストの種類が異なる場合もあり単純にこれらの結果を比較できない部分もあるが,RNA顆粒構成IDPが長期記憶形成に必ずしも影響を及ぼすわけではないことが示唆される.一方,Caprin1(RNG105)はその欠損により,空間学習と恐怖条件づけ学習において,長期記憶が顕著に低下する24).
そこで,Caprin1と上述の他のIDPの間の相違点を考えてみたい.前章2.3節でふれたように,Caprin1の特筆すべき性質として,形成する顆粒が強い液相性を示すことがあげられる.この液相性は同じく液相様IDPであるG3BP1よりも顕著に高く47),分子の出入りや翻訳活性の上昇が起こりやすい場の形成に大きく寄与する可能性が考えられる.RNA顆粒は固相様の性質が増すと凝集化し,筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS)や前頭側頭型認知症(frontotemporal dementia:FTD)といった神経変性疾患をもたらすリスクが高まると考えられるため,固相に極度に傾かないような,液相–固相バランスの維持が常に求められる.そのうえで,さらに翻訳という一連の生化学反応を顆粒内で起こさせるには,分子の出入りや運動が起こりうる液相状態にバランスが傾くことが必要だと考えられる.このような顆粒の流動性制御が,局所翻訳を介した長期記憶形成に重要な役割を果たすのかもしれない.より詳細な顆粒の物性や局所翻訳との関わりを解析する必要があるが,“顆粒の流動性制御”という数年前にはなかった新たな視点が,局所翻訳を理解するための本質的な問いをひもとく鍵になることが期待される.
RNA顆粒のLLPSや流動性制御が長期記憶形成や神経変性疾患にいかに関わるかを研究するためには,LLPSや流動性を生体の脳神経で計測・操作する技術が必要になる.それらの技術はこれまで,in vitroおよび培養細胞で開発が行われてきた.今後それらの技術がin vivoにも適用されるべく改良が進むと期待されるが,特に,培養細胞で開発されてきた蛍光計測・操作技術が応用・適用されていくと考えられる.そこで,神経細胞に限らず,一般に細胞内でLLPSや流動性の計測・操作に用いられている代表的な方法について簡単に紹介する.
細胞内で特定のタンパク質がLLPSを起こしているか否かを評価する際に最もよく用いられている指標は,コンデンセートどうしが融合するか否かである61).コンデンセートが液相であれば表面張力によってできるだけ球体になろうとするため,融合後,融合点の径が増大していく.このとき,ライブイメージングでランダムに起こる融合を観察する方法もあれば,光ピンセット等を用いてコンデンセートどうしを近づけるように操作する方法もある.また,コンデンセートのダイナミクスを解析する際によく用いられるのが光退色後蛍光回復法(fluorescence recovery after photobleaching:FRAP)である61).これは,解析対象となるタンパク質を蛍光でラベルし,LLPSにより形成されたコンデンセートに対してレーザー光を照射して蛍光を退色させ,その後,照射領域における蛍光の回復度を計測する方法である.コンデンセートへの分子の出入り速度およびコンデンセート内での分子の流動性が高ければ蛍光の回復度は高く,その逆であれば蛍光の回復度は低くなる.以上のような手法により,LLPSにより形成されたコンデンセートにおける分子のダイナミクスを評価することができる.
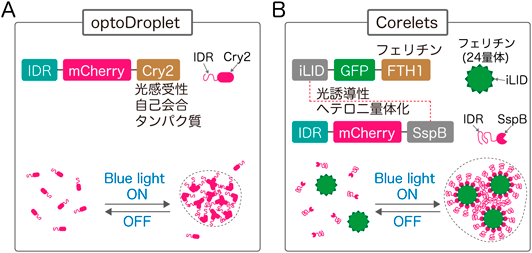
さらに,光照射により細胞内でのLLPSを操作するツールとして,“optoDroplet”62)と“Core scaffolds to promote droplets(Corelets)”63)が開発された(図6).これらの方法は,「IDRの多量体化が相互作用の多価性を上昇させ,LLPSを促進する」という性質を利用したものである.この開発のヒントになったのは,生物に存在するIDPの多くが,構造を持った多量体化ドメインの結合を介してIDRの多価化およびLLPSを引き起こすという知見である.“optoDroplet”は多量体形成ドメインとして,青色光の照射により自己会合する光感受性タンパク質Cry2を用いる.Shinらは,特定のIDRにmCherryとCry2を融合させたタンパク質を培養細胞内に発現させ,青色光照射依存的にコンデンセートを形成させることに成功した62)(図6A).この方法では,青色光照射から数秒後にはコンデンセートの形成が認められ,光照射中は形成が維持され,光照射をOFFにするとコンデンセートの形成は解消される62).よって,任意のIDPについて任意のタイミングで生細胞内で相分離を起こすことができる画期的なツールとして注目されている.
optoDropletをさらに改良した方法として報告されたのが“Corelets”である.optoDropletではCry2のホモ多量体化が直接LLPSを起こしてしまう可能性が排除できず,IDR依存的なLLPSの厳密な定量性に欠ける.また,光照射OFF後のCry2の不活性化時間に数分を要するため,光照射領域外に拡散したCry2がその数分間,活性化型として多量体を形成してしまい,厳密な局所での活性制御が難しい.そこでBrachaらは,IDRの多量体化を操作する方法として“Corelets”を開発した.GFPタグ化フェリチンに光活性化ドメインであるiLIDドメインをつなげたタンパク質と,iLIDとヘテロ二量体を形成するSspBに任意のmCherryタグ化IDRをつなげたタンパク質を培養細胞に共発現させる.フェリチンは24個のサブユニットが自己集合した球形の構造をとるため,IDR多量体化の核となるが,これ自体がLLPSを起こすことはない.青色光照射に応答してiLIDとSspBがヘテロ二量体を形成するため,iLID-GFPフェリチン24量体とSspB-IDR-mCherryが結合してIDRが多価化し,それに依存してコンデンセートが形成される(図6B).青色光照射開始の数秒後にはコンデンセートの形成が認められ,また,光照射OFF後1分程度で形成が解消される63).細胞全体のみならず局所での制御,また,低濃度でのコンデンセート形成に成功しており,生体での相分離を模倣しうる系として報告されている.このような生細胞内でコンデンセート形成を操作する系を生体に適用することで,相分離の生理的意義の理解が進むことが期待される.