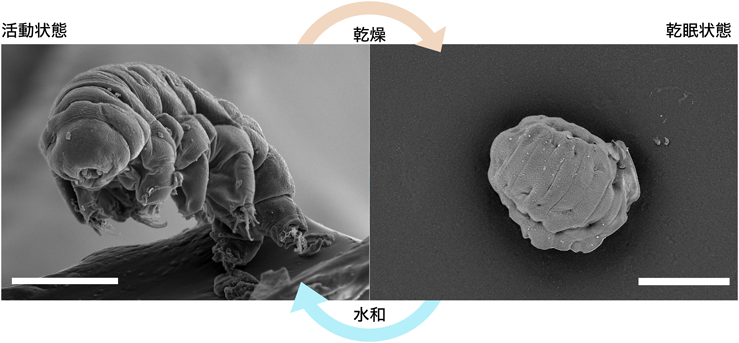
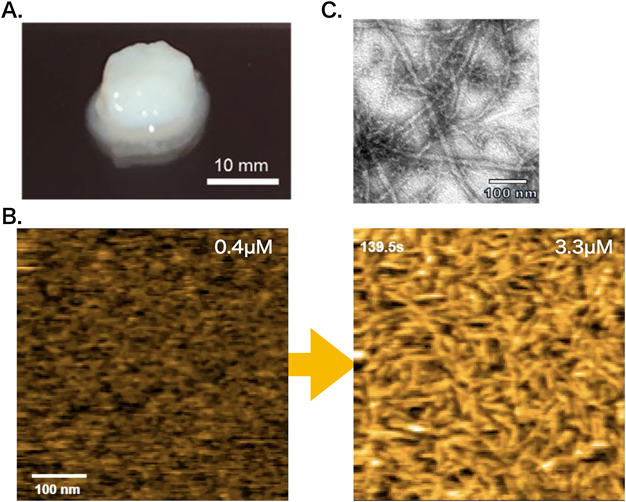
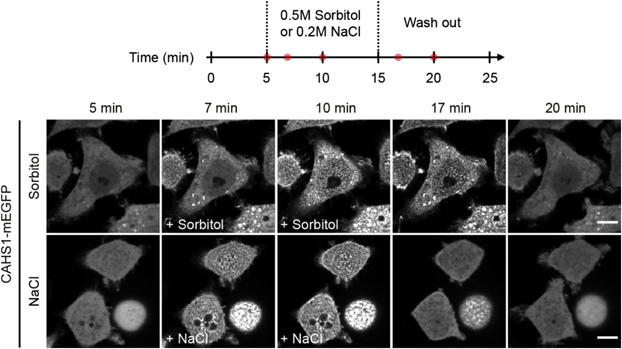
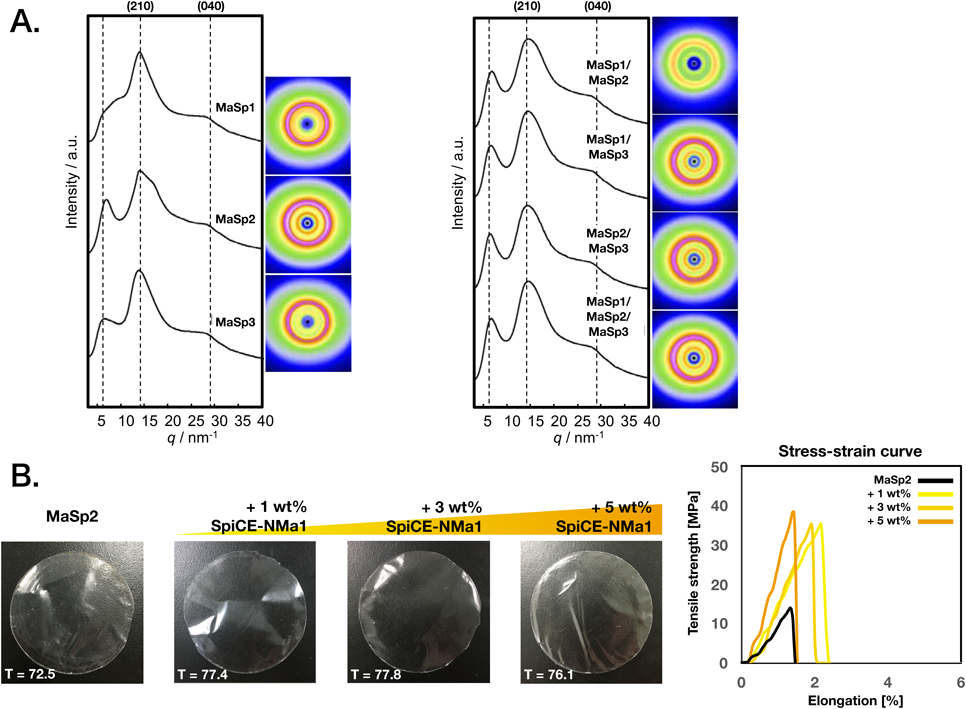
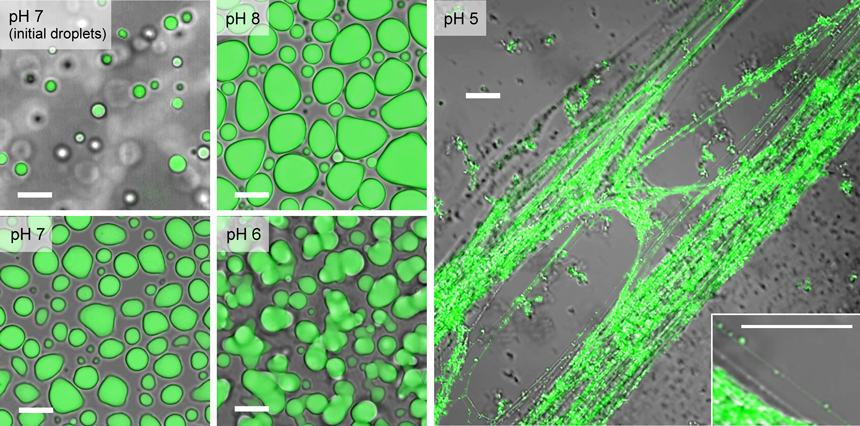
生物材料・生体機能発現と液–液相分離:クマムシ乾眠とクモの糸Liquid–liquid phase separation seen in tardigrade anhydrobiosis and spider silk spinning
1 慶應義塾大学先端生命科学研究所Institute for Advanced Biosciences, Keio University ◇ 〒997–0017 山形県鶴岡市大宝寺字日本国403–1 ◇ Nihonkoku 403–1, Daihoji, Tsuruoka, Yamagata 997–0017, Japan
2 慶應義塾大学大学院政策・メディア研究科Graduate School of Media and Governance, Keio University ◇ 〒252–0882 神奈川県藤沢市遠藤5322 ◇ 5322 Endo, Fujisawa-shi, Kanagawa 252–0882 Japan
3 自然科学研究機構生命創成探究センターExploratory Research Center on Life and Living Systems (ExCELLS), National Institute of Natural Sciences ◇ 〒444–8787 愛知県岡崎市明大寺町字東山5–1 ◇ 5–1 Higashiyama, Myodaiji, Okazaki, Aichi 444–8787, Japan