液–液相分離(以下,相分離)は近年,細胞が膜のないオルガネラ(非膜型細胞小器官)を構成する際に利用されるメカニズムとして脚光を浴びている.このような非膜型細胞小器官として代表的なものにストレス顆粒(stress granule:SG)と呼ばれる構造体があり,その構成成分としてポリ(A)+ RNAやRNA結合タンパク質,40Sリボソームなどが含まれている1).SGは当初,mRNAの分解や安定性など転写後制御に関わる「RNAの運命決定装置」として認識されていた.近年,SGが多様なストレスに応答した細胞の生存戦略としての役割に加え,がんや神経変性疾患,ウイルス感染などの病態と深く関わることが明らかになり,SGの制御メカニズムは疾患治療の観点からも注目を集めている2).杉浦の研究グループは,遺伝学に加え,薬理学的解析が駆使できる分裂酵母モデル生物を用いた独自の遺伝薬理学的手法により,mitogen-activated protein kinase(MAPK)シグナル依存的にSGに取り込まれるRNA結合タンパク質Nrd1を同定し3),MAPKシグナル制御とSG形成の関わりを探ってきた.その結果,MAPKの上流活性化因子であるprotein kinase C(PKC/Pck2)が,MAPKシグナル依存的にSGに取り込まれることによりMAPKシグナルの過剰な活性化を防ぐネガティブフィードバックループを形成することを見いだした4).このように重要なシグナル因子を時空間的にオーガナイズする「シグナル制御ハブ」としてのSGの役割は,種を超えて保存されていることも明らになりつつある5).また,がん細胞の生存戦略としてのストレス顆粒の役割や,抗がん剤耐性におけるSGの報告も蓄積しつつある6).本稿では,MAPKを中心としたシグナル伝達制御とSGの関わり,SG制御を標的としたがん治療への応用の可能性について紹介する.
SGは高温やヒ素,低酸素,酸化ストレス,ウイルス感染など,特定のストレス刺激に応答してダイナミックに形成される細胞内構造体である1).SGは,ストレスに応答してmRNAやRNA結合タンパク質をその内部に取り込み,翻訳を一時的に停止することにより,異常タンパク質の蓄積を防ぎ,ストレスによるダメージを回避する細胞の生存戦略と考えられている.すなわち,SGが形成されると,基本的な細胞機能に必要なタンパク質をコードする“ハウスキーピング遺伝子”などのmRNAが顆粒内へ取り込まれ,一部のタンパク質への翻訳が一時的に停止する.SGの形成は動的かつ可逆的であり,細胞がストレスから回復するとSGは数分で消失して翻訳が再開される.このような一過性の翻訳抑制は,異常タンパク質の蓄積を防ぎ,さらなる細胞損傷を回避する重要なストレス適応機構として機能していると考えられるが,その詳細な分子機構や構成因子,生理機能の多くは不明である.一方,SGの形成を誘導するさまざまなストレスは細胞を取り巻く環境からのシグナルであり,細胞はこれらのストレスシグナルを感知し,個々の細胞内シグナル伝達経路を起動することにより,ストレス下での生存を巧妙に調節する.さらに,SGの形成は可逆的であり,ストレスが去ると速やかにSGも消失することから,迅速かつ鋭敏なシグナルのON/OFF制御に適している.必然的にSG形成機構と細胞内ストレスシグナル伝達経路は密接にクロストークする.
1)遺伝学的手法を用いたMAPKシグナル標的因子としてのストレス顆粒制御因子の同定
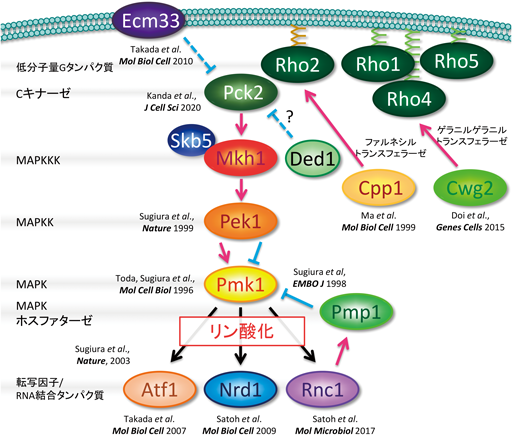
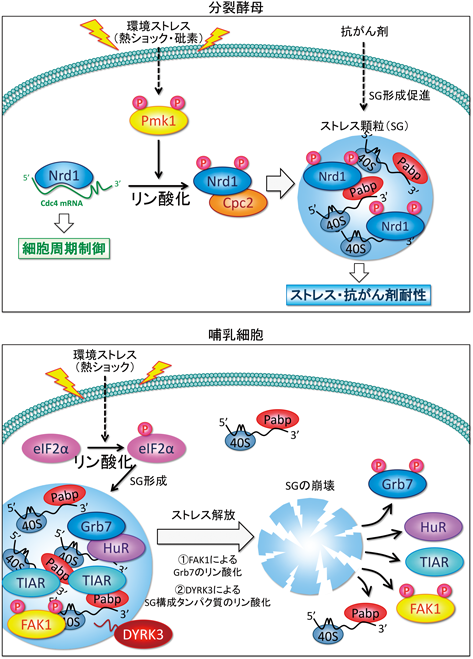
MAPKシグナル伝達経路はすべての真核生物において高度に保存されており,MAPKKK/MAPKK/MAPKという三つのリン酸化酵素(キナーゼ)による連続したリン酸化反応により外界からのシグナルを細胞内に伝達する7).高等生物においては,ERK, JNK, p38の少なくとも3種類のMAPKのサブファミリーが存在する.分裂酵母には高等生物のRAF/MEK/ERKシグナル伝達経路と相同なMkh1/Pek1/Pmk1 MAPKシグナル伝達経路が存在する8).杉浦らは,分裂酵母を用いた独自の遺伝学的スクリーニングを確立し,ERKのホモログであるPmk1 MAPK8)の制御因子,標的因子群を同定してきた9, 10).そのプロセスにおいて複数のmRNA結合タンパク質が同定されている(図1)9, 10).Pmk1 MAPKの標的因子の一つであるNrd1はRRM(RNA recognition motif)型mRNA結合タンパク質であり,標的mRNAであるCdc4 mRNAの安定化を介して,細胞質分裂を制御する10).さらにPmk1 MAPK依存的なNrd1のリン酸化は,Nrd1のRNA結合能を負に制御する.興味深いことに,Nrd1は高等生物におけるSG形成の鍵となるRNA結合タンパク質TIA-1(T-cell internal antigen-1)/TIAR(TIA-1-related protein)と同様にSGの制御因子として重要な役割を担うことが明らかになった3).すなわち,熱ショックやヒ素などのストレス刺激に応答して,Nrd1はSGマーカーであるポリ(A)結合タンパク質(poly(A)-binding protein:PABP)と共局在する.一方,これらのSG誘導ストレスは,Pmk1 MAPKの活性化とそれに引き続くNrd1のリン酸化を誘導する.さらにNrd1過剰発現は,ストレス非存在下でSG形成を誘導し,その効果はMAPKによるリン酸化mimic体であるNrd1DD過剰発現でより顕著であった(図2)3).高等生物のTIA-1/TIARにおいても,過剰発現に伴い自らが凝集体を形成し,SGの核(seeds)としてSG形成を誘導,制御することが報告されている.一方,Nrd1ノックアウトはSG形成の遅延と,各種ストレスに対する超感受性を示した3).さらに,MAPKシグナル依存的なNrd1のSG誘導には,Cpc2とNrd1のリン酸化依存的な複合体形成が重要な役割を担うことも明らかになった3).すなわち,細胞が熱ストレスなどの環境ストレスに曝露されると,Nrd1はPmk1 MAPKによりリン酸化される.リン酸化型のNrd1はCpc2と複合体を形成し,SGの核を形成し,ストレス耐性に関わる.ストレスから解放されるとNrd1はSGから離脱し,再び標的mRNAと結合することにより細胞周期を制御する.したがって,Nrd1はMAPKのリン酸化依存的にSG形成を介して細胞運命決定に関わるRNA結合タンパク質である(図2).
2)翻訳後修飾とストレス顆粒制御
高等生物においても,RNA結合タンパク質の多様な翻訳後修飾がSGの形成制御に関わる例が報告されている11, 12).Nrd1同様に,RNA結合タンパク質がキナーゼによるリン酸化依存的にSG制御のON/OFF調節を行う例としてGrb7がある13).Grb7はSGの構成因子であり,非リン酸化状態においてRNA結合タンパク質HuRと結合し,TIA-1の凝集を安定化させることによりSG形成を促進する.興味深いことに,Grb7のリン酸化酵素であるFAK(focal adhesion kinase)はストレスに応答してSGに取り込まれるが,細胞がストレスから回復するステップではFAKによりGrb7がリン酸化されると,HuRとGrb7の結合が阻害されることにより,Grb7はSGから解離し,SGが崩壊する.すなわちFAKによるGrb7のリン酸化はストレス消失後の迅速なSGの脱会合と翻訳開始の鍵を握る13).同様にSGの脱会合において重要な役割を担うキナーゼとして,DYRK3(dual-specificity tyrosine-phosphorylation-regulated kinase 3)がある14).DYRK3はN末端の天然変性領域(intrinsically disordered region:IDR)を介してSGに局在化するが,SGにおいて複数のSG構成タンパク質をリン酸化することにより,ストレスからの回復時にSGを消失させる役割をもつことが報告されている14).
翻訳開始因子,eIF2のαサブユニットであるeIF2αのSer51のリン酸化はSG形成の律速段階を調節する重要な翻訳後修飾である15).細胞はストレスに曝露されると,細胞活動の負荷を下げるとともに,ストレスによって引き起こされるタンパク質合成のエラーを防止するために全体的な翻訳を停止する.一方,特定のストレス応答タンパク質の合成を始めることで,ストレス環境への適応を行う.細胞がストレスを感知すると,eIF2がリン酸化される.通常eIF2は,他の翻訳開始因子であるeIF2BによってGDP結合型(不活性型)からGTP結合型(活性型)へと変換されることで活性化されて翻訳を開始する.しかし,ストレスに応答してリン酸化されたeIF2は,eIF2Bの機能を阻害する分子へと変化し,その結果,細胞内の活性型eIF2が減少して翻訳抑制をはじめとする一連のストレス応答が開始する.この変化は,酵母からヒトに至る真核生物に共通したメカニズムである(図2).
リン酸化以外の翻訳後修飾として,メチル化,アセチル化,ユビキチン化,SUMO化,O-GlcNAc化などがSG構成因子,特にリボソームタンパク質やmRNA結合タンパク質の翻訳後修飾を介してSG形成を正あるいは負に制御する.これらの翻訳後修飾は外界からの刺激によってダイナミックに変化し,タンパク質間相互作用に影響を与える.ヒ素などのSG誘導刺激がSG構成因子の多くをO-GlcNAc化すること,逆にO-GlcNAc転移酵素のノックダウンがSG形成を阻害するなど,O-GlcNAc化はSGの形成のみならず融合のプロセスにも影響があることが報告されている16).また,脱ユビキチン化酵素USP5とUSP13はSGに局在することによりSG内のさまざまなタンパク質のユビキチン鎖を分解するが,USP5とUSP13がノックダウンされるとSG内にユビキチンタンパク質が過剰に蓄積し,SGの消失が遅延する.このことから,USP5とUSP13を介する脱ユビキチン反応はストレス解消後にSGが速やかに消失するために不可欠であることが明らかにされている17).相分離には,分子間の多価(multi-valent)の相互作用が必要であり,その相互作用には,タンパク質に存在するIDRが関与する.シグナル伝達分子内の相互作用に関わるSH3ドメインやWDモチーフ等はIDR内に存在することが多い.リン酸化をはじめとする翻訳後修飾は,シグナル分子間,あるいはシグナル分子と核酸の相互作用にも影響を与えることにより相分離を制御すると考えられる.今後これらの翻訳後修飾が,相分離の標的となる分子の相互作用とSGの凝集・離散に与える詳細な分子機構の解明が待たれる.
3. シグナル伝達制御におけるストレス顆粒の役割:シグナル伝達ハブとしてのストレス顆粒
ERK経路やPI3K/AKT経路などのシグナル伝達経路がSGを制御する機構が次第に明らかになると同時に,SGがさまざまなシグナル伝達経路の調節を介して細胞の運命決定に関わる例が多数報告されている.このような「シグナル伝達ハブ」としてのSGの役割に関する先駆的な研究として,さまざまなシグナル伝達経路の活性化因子のSGへの取り込みの例がある.ストレス応答MAPKKKであるMTKの活性化因子であるRACK1(receptor for activated C-kinase 1)のSGへの隔離は,p38/JNK経路の失活とDNA損傷に伴う細胞死の阻害につながる18).さらにmTORC1(mammalian/mechanistic target of rapamycin 1)のSGへの取り込み,NF-κB活性化因子であるTRAF2の取り込みを介した細胞死の制御の例がある19).特にmTORC1のSGへの隔離は酵母で発見され,次いで哺乳動物においても同様のメカニズムが確認された20, 21).
1)PKC/MAPK経路の新規制御タンパク質の探索とストレス顆粒制御因子の同定
筆者らは,MAPKの上流活性化因子であるPKCの分裂酵母オルソログPck2の局在解析を通して,相分離とSGを介する新たなMAPKシグナル制御システムを発見した4).PKCファミリーは酵母からヒトまで高度に保存されたAGCキナーゼスーパーファミリーであり,MAPKをはじめとした細胞内シグナル伝達経路の活性化を介して増殖や細胞死,がん化と密接に関わる.PKCファミリーはさまざまな刺激に応答して細胞膜,ゴルジ体や核などのオルガネラにトランスロケーションすることがよく知られている22).すなわち,PKCの生理的な活性と細胞内局在は連動しつつ,緻密に制御されている.近年高等生物において,PKCαが熱やヒ素に応答してSGに局在することが報告されたが,そのメカニズムや生理的意義については不明であった23).筆者らは,遺伝学的手法を用いることにより,Pck2/Mkh1/Pek1/Pmk1 MAPKシグナル制御因子の同定を行ってきた.この遺伝学的スクリーニングは,Pck2過剰発現に伴うMAPKの強い活性化が細胞死を誘導するという知見に立脚し,MAPKシグナルを阻害する,あるいはMAPK経路の活性化因子をノックアウトすると,Pck2過剰発現に伴う細胞死が回避され,細胞が増殖することを利用している.これまでにdual-specificity MAPK phosphataseをコードするPmp1, MAPKKKであるMkh1の局在を空間的に制御するアダプタータンパク質Skb5などを同定してきた24, 25).今回,筆者らは新たにPck2過剰発現に伴う細胞死を回復する因子として,高度に保存されたSGの制御因子であるDed126)を同定したことから4),Pck2-Pmk1 MAPKシグナルの活性制御にSGが関わるという仮説のもと解析を進めた.
2)PKC/Pck2は熱ストレス依存的に誘導されるストレス顆粒に隔離される
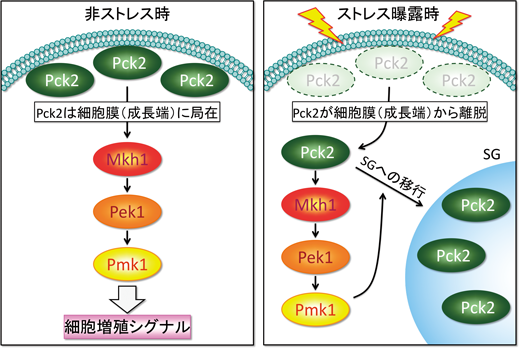
まず,代表的なSG誘導ストレスである熱刺激(heat stress:HS)条件下で,内在性のプロモーター下で発現させたPck2-GFPの局在変動を観察した.Pck2はストレス非存在下では,細胞膜の成長端(growing ends)および細胞質に局在するが,HS曝露後5分の時点でPck2の成長端(膜)局在は消失し,HS処理20分後にはPck2はSGマーカータンパク質Pabpポジティブな顆粒状構造に移行した4).この熱刺激に伴うPck2の顆粒状構造はSG形成を阻害するシクロヘキシミドの添加で消失したことに加え,熱刺激に伴いPck2とPabpが可溶相から凝集相に移行したことから,熱刺激は相分離を介してPck2のSG移行を促進したと考えられる.さらに,HS依存的なPck2のSG局在は,Pck2のキナーゼ活性に依存した.つまり,キナーゼ活性を持たない(kinase-dead変異)Pck2はSG局在が減少し,恒常的活性化型変異Pck2は強くSGに集積した.さらに,細胞内で活性化型Pck2と不活性型Pck2を異なる蛍光標識で可視化した場合,活性化Pck2がHSに応答して優先的にSGに移行することからも,SGは活性のあるPck2を選択的に取り込むことが示唆された(図3)4).
3)Pck2はMAPKシグナル活性依存的にSGに移行する
Pck2はPmk1 MAPKの上流活性化因子であることから,HSがPmk1 MAPKの活性化に与える影響を調べた結果,HS曝露後5分の段階でPmk1は強く活性化された.すなわちHS依存的なPmk1 MAPKの活性化はPck2のSG移行に先行したことから,Pmk1 MAPKの活性化がPck2のSG局在を誘導している可能性が示唆された.そこで,Pmk1 MAPKノックアウト細胞におけるHS依存的なPck2のSG移行を解析した結果,Pck2のSG局在は正常細胞と比較して顕著に減少した.さらに重要なことに,恒常的活性化型のPck2もPmk1ノックアウト細胞ではSGへの移行が顕著に阻害された.一方,MAPKの脱リン酸化酵素であるPmp1ノックアウト細胞ではPmk1 MAPKが活性化することにより,Pck2のSG移行が上昇した4).すなわち,SGは活性のあるPck2を取り込む役割があること,Pck2のキナーゼ活性は自らのSG移行にとって必要であるが,下流のPmk1 MAPKシグナルの活性化状態がPck2のSG移行の決定要因となることから,SGはPck2/Pmk1 MAPKシグナルのネガティブフィードバック機構としての役割を有することが示唆された(図3).
4)ストレス顆粒へのPKC/Pck2の隔離はMAPKの過剰な活性化を防ぐ安全弁として機能する
それでは,Pck2のSG移行はMAPKシグナルの活性に影響を与えるのだろうか? そこでSGの制御因子であるNrd1ノックアウト細胞あるいは翻訳開始因子であるeIF2αのリン酸化変異体においてPck2のSG移行を観察した.驚くべきことに,これらのSG変異体は43°Cの熱刺激(mild heat stress:MHS)で形成されるSGは顕著に阻害するが,Pck2がSGに移行する45°Cという熱刺激(high heat stress:HHS)により誘導されるSG形成には影響を与えず,Pck2自身のSG移行にも影響しなかった.つまり43°C,あるいは45°CのHSによって誘導されるSGは,それぞれ形成メカニズムや構成因子が異なることを示唆するとともに,Pck2がSGに移行する際に45°Cという閾値が存在することを示唆する.そこで,筆者らはSG形成がPck2のSG局在とMAPKシグナルに与える影響を評価するために,熱ストレス負荷と熱ストレス解放を反復することにより,SG凝集と離散を可逆的に誘導した.その結果,HHSに20分以上曝露されると,HHSから解放された2時間後にもPck2はSGに滞留し,Pck2がSGに取り込まれている状態ではHHSを与えてもMAPKの再活性化が誘導されなかった.反対に,Pck2がSGに局在しない状況ではHHSによる迅速かつ強いMAPKの再活性化が誘導された.以上の結果から,Pck2のSGへの隔離はMAPKのHHSによる再活性化を防ぐことが明らかになった.さらにPck2がSGにリクルートされる強い熱刺激はPck2の相分離を引き起こすのに対して,弱い熱刺激はPck2の相分離を誘導しなかった.また,HHSに伴う相分離は,可溶化相におけるPck2のキナーゼ活性を低下させた.これらの結果は,相分離を介して形成されたSGは,活性のあるPck2を細胞質から空間的に隔離し,Pck2の基質やPck2の活性化因子と隔絶した環境にとどめることにより,MAPKシグナルを遮断する働きがあることを示唆する.前述のように,Pck2の相分離にはHHSが必要であることからも,SGは,ある閾値を超えた過度なMAPKの活性化が誘導する細胞死を未然に防ぐ安全弁としての役割を有すると考えられる4).興味深いことに,mTORC1あるいはRaptorのSGへの取り込みも,ストレス環境下でmTORC1活性が過剰になることによるアポトーシスを回避していると考えられている.したがって,シグナル伝達のセーフガードとしてのSGの役割は種を超えて保存されていると推測される(図3).
SGは進化的に保存された細胞のストレス適応戦略であると同時に,がん細胞においても生存戦略としての役割を担う.がん細胞は常に低酸素や低栄養など,ストレスフルな環境に適応しつつ,増殖を維持する必要があることから,がん細胞のストレス応答システムを標的としたがん治療戦略が注目されている.特にSGは抗アポトーシス効果と薬剤抵抗性を介してがん細胞に対する保護的な役割を発揮することからも,魅力的な治療標的である.
1)ストレス顆粒は抗アポトーシス効果を発揮する
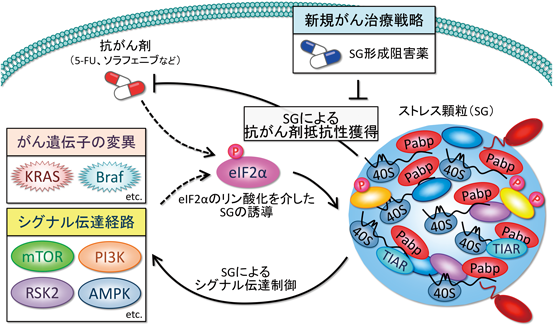
SG形成ががん細胞を細胞死から保護する役割があることは,SG形成の有無が薬剤や抗がん剤により誘導される細胞死に対する感受性に影響を与えることから示唆されていた.たとえばヒ素処理によりSGが誘導された小腸上皮細胞は,ヒ素未処理の細胞と比較して,TNFα処理に伴う細胞死に対して抵抗性を示す27).さらに抗がん剤の一種であるボルテゾミブ投与に対して,SGを形成しない乳がん細胞(Hs587T)はSGを形成する他の乳がん細胞と比較して細胞死がより起こりやすいことが報告されている28).興味深いことに,SGの持つ抗アポトーシス活性は,前述の「シグナル伝達ハブとしてのストレス顆粒の役割」と密接に関わる.SGはさまざまなシグナル因子をストレスに応答して取り込む働きがあるが,特にアポトーシス促進因子がストレス顆粒に取り込まれることによって,抗アポトーシス効果を発揮する.代表的なmTOR経路とSAPK経路を例にとり紹介する(図4).
a.mTORC1
mTOR経路の過剰な活性化は細胞死を誘導するが,mTORC1複合体の構成因子であるmTORおよびその結合因子であるRaptorやPRAS40はアポトーシス促進因子として働く29).一方,mTORC1の負の制御因子として同定されたAstrinはmTORと競合的にRaptorと結合し,Astrin/Raptor複合体を形成する.ストレス環境ではAstrin/Raptor複合体はSGにリクルートされるため,mTORC1複合体の形成と細胞死が阻害される.すなわち,AstrinはmTORC1の過剰な活性化を防ぐことによりSGの抗アポトーシス効果に関与する.重要なことに,Astrinは多くの腫瘍において高発現しており,がん細胞が細胞死を回避するためにはAstrinが必要であることからも,Astrinは腫瘍選択的に細胞死を誘導する有望な治療標的と考えられる21).
b.SAPK/JNK
ストレス応答MAPK経路であるSAPK/JNK経路もストレス顆粒を介して細胞死の制御に関わる.SAPK/JNK経路は抗がん剤であるシスプラチンや熱ショックにより活性化され,アポトーシスを促進する.前述のRACK1のSGへの隔離と細胞死の抑制効果は,「腫瘍内部低酸素環境におけるがん細胞の抗がん剤抵抗性獲得」の一因となることが示されている.RACK1は足場タンパク質としてMTK1を二量体化し,活性化を促進するが,低酸素環境でSG形成が誘導されるとRACK1はMTK1から解離してSGに取り込まれる結果,MTK1が不活性化される.結果的にSAPK/JNK経路の活性化が抑制され,抗がん剤によるアポトーシスが阻害される18).同様に,JNKの上流因子であるROCK1(Rho-associated, coiled-coil containing protein kinase 1)も,SGに取り込まれる.ROCK1はJNK活性化因子であるJIP-3(JNK-interacting protein 3)のリン酸化と活性化に不可欠なキナーゼである.熱刺激に応答して,RhoAが活性化すると,RhoAにより活性化されたROCK1はRhoAとともにSGに取り込まれる.SGの形成が阻害されると,ROCK1は細胞質でJIP-3をリン酸化し,リン酸化されたJIP-3はJNKの活性化と細胞死を誘導する30).
以上のように,細胞質内SGはストレス応答MAPK経路やmTOR経路の活性を多様なアポトーシス促進因子の取り込みを介して阻害し,細胞死を回避している.
2)ストレス顆粒は抗がん剤耐性を付与する
抗アポトーシス効果以外にも,SGは薬剤抵抗性を付与することによりがん細胞の保護に関わる.たとえば,SG形成の核となるRNA結合タンパク質の一つであるG3BP1を過剰発現することにより,ストレス非存在下においてもSG形成が亢進し,薬剤抵抗性が回復することが知られている31).一方,多種多様な抗がん剤がSGを誘導することが報告されている32).代表的な化学療法剤である5-Fluorouracil(5-FU:核酸合成阻害),あるいはプロテアソーム阻害剤であるボルテゾミブ,マルチキナーゼ阻害剤であるソラフェニブなどが,間接的にeIF2αのリン酸化を介してがん細胞にSGを誘導することが知られている.個々の抗がん剤がSGを誘導するメカニズムについては他の詳細な総説を参照されたい32).結果的にこれらの抗がん剤により誘導されたSGは細胞死の抑制に働くため,SGはストレス刺激のみならず,抗がん剤に対してもがん細胞の抵抗性を高める仕組みとして活用されている(図4).
3)がんの進展とストレス顆粒
PKCやMAPK, mTORという細胞の増殖に関わるシグナル伝達経路の制御とSGの関わりが明らかになったことからも,がん化シグナル,さらにはがんの進展とSGの関わりが注目を集めている.まず多くの生物種において,mTOR, PI3K, RSK2, AMPKなどの生存や増殖に関わるシグナル伝達経路がSGの形成を促進することが報告されている.前述のように,SGはストレス存在下の細胞の適応戦略であるため,これらのシグナル伝達経路がSG形成を促進することは理にかなっていると考えられる.近年注目を集めた研究に,がん遺伝子異常とがん細胞特異的な代謝がSGを促進するという報告がある.すなわち,代表的ながん遺伝子であるKRAS変異やBraf変異を有するがん細胞では,さまざまなストレス誘導刺激や抗がん剤刺激に応答したSG形成が高度に亢進していることが明らかになった33).KRAS活性化型変異を有する膵がん細胞では,シグナルリピッドである15-deoxy prostaglandin J2(15-d-PGJ2)の分泌が亢進しており,SGの誘導ならびに抗がん剤耐性を付与し,がん細胞の生存に寄与する.興味深いことに,臨床腫瘍検体を用いた解析から,プロスタグランジンの合成酵素であるcyclooxygenase PTGS2(COX-2)高発現,プロスタグランジン分解酵素であるNAD+–dependent 15-hydroxyprostaglandin dehydrogenase(HPGD)低発現の患者は予後不良であることが示唆された.このことは,臨床においてSG形成と関連分子が,がんの悪性度や進展を予測するマーカーとしても利用できることを示唆している.実際に,SG制御因子G3BP1に関しても,G3BP1量が高いがん細胞はSG形成が亢進し,予後が不良であった34).また,YB-1はG3BP1の翻訳活性化を介してSG形成を促進するが,ヒトSarcomaにおいてYB-1の高発現はG3BP1の発現亢進と相関を示し,予後不良マーカーとされる35).同様に,ヒト非小細胞肺がんにおいてもYB-1とG3BP1の発現はTNM(tumor node metastasis)ステージや転移のレベルと正の相関があった36).一方,YB-1をノックダウンした腎がん細胞では,SGの数が激減するとともに,がんの浸潤や肺への転移も顕著に低下した.これらの研究成果は,YB-1が強力な転移促進因子であることを示唆すると同時に,SGの構成因子,あるいはSGの形成機構を標的としたがん治療につながる可能性を秘めている(図4).
5. おわりに:がん治療標的としてのストレス顆粒の展望
本稿で示したように,シグナル伝達と相分離(ストレス顆粒形成)の制御,さらにシグナル伝達とがんの進展制御は双方向性である.特に,がん化シグナルがSG形成を亢進し,さらに形成されたSGはがん細胞にストレス依存的な細胞死の回避や抗がん剤耐性を付与することによりがん細胞の生存に貢献する.このようなシグナル伝達とSGの相互依存的な関係をブロックすることは魅力的ながん治療となりうるであろう.SG形成ががん細胞選択的に亢進していること,また同レベルのストレスに対してもがん細胞の方が有意にSGを高発現させていることからも,SGを標的としたがん治療はがん細胞選択的な治療につながる可能性を秘めている.特にSGにより誘導される抗がん剤抵抗性は,化学療法剤から分子標的治療薬まで幅広い薬剤の有効性と患者の予後に関わる臨床上の重要な課題である.今後これらの抗がん剤と,SG形成阻害あるいはSG離散促進に働く薬剤との併用療法が抗がん剤抵抗性回避につながることが期待される.SGを標的とした化合物開発の作用点としては,eIF2αのリン酸化,mTORやCK2などのシグナル分子,微小管重合などの細胞骨格系,TIA-1, G3BP, TDP43などのストレス顆粒形成の鍵を握るRNA結合タンパク質,あるいはユビキチン化,アセチル化,リン酸化などSG形成に影響を与える翻訳後修飾などが考えられる.今後,これまで主に細胞培養系において進められてきたSG解析やさまざまな化合物の影響を,in vivoのモデル動物やライブイメージングなどの手法で検証していく必要がある.また,SG形成に影響を与える薬物の長期にわたる副作用や毒性,個々の薬物の標的分子の同定やProof of Conceptなども克服すべき課題である.また,猛烈な勢いで進歩するゲノム解析により,さまざまな臨床がん特異的な遺伝子異常とSG形成異常,あるいはがん特異的な代謝物パスウェイとの関係も明らかになっていくであろう.一方,PKC/MAPKシグナルは高度に保存されたシグナル経路であり,その過剰な活性化はがん化のプロセスに直結する.今回我々の発見したPKC/MAPKシグナルのセーフガードとしてのSGの働きがヒトにおいても保存されていることが期待される.今後ストレス顆粒を標的とした創薬戦略を提唱する上でも,遺伝薬理学,ケミカルゲノミクスを応用でき,しかも高等生物に外挿しうる成果を導くことのできる酵母やハエ,線虫といったモデル生物研究の有用性にもいっそう期待していきたい.
引用文献References
1) Anderson, P. & Kedersha, N. (2006) RNA granules. J. Cell Biol., 172, 803–806.
2) Wang, F., Li, J., Fan, S., Jin, Z., & Huang, C. (2020) Targeting stress granules: A novel therapeutic strategy for human diseases. Pharm. Res., 161, 105143.
3) Satoh, R., Tanaka, A., Kita, A., Morita, T., Matsumura, Y., Umeda, N., Takada, M., Hayashi, S., Tani, T., Shinmyozu, K., et al. (2012) Role of the RNA-binding protein Nrd1 in stress granule formation and its implication in the stress response in fission yeast. PLoS One, 7, e29683.
4) Kanda, Y., Satoh, R., Takasaki, T., Tomimoto, N., Tsuchiya, K., Tsai, C.A., Tanaka, T., Kyomoto, S., Hamada, K., Fujiwara, T., et al. (2021). J. Cell Sci., 134, 250191.
5) Kedersha, N., Ivanov, P., & Anderson, P. (2013) Stress granules and cell signaling: more than just a passing phase? Trends Biochem. Sci., 38, 494–506.
6) Song, M.S. & Grabocka, E. (2020) Stress granules in cancer. Rev. Physiol. Biochem. Pharmacol. doi: 10.1007/112_2020_37.
7) Sugiura, R., Satoh, R., & Takasaki, T. (2021) ERK: A Double-edged sword in cancer. ERK-dependent apoptosis as a potential therapeutic strategy for cancer. Cells, 10, 2509.
8) Toda, T., Dhut, S., Superti-Furga, G., Gotoh, Y., Nishida, E., Sugiura, R., & Kuno, T. (1996) The fission yeast pmk1+ gene encodes a novel mitogen-activated protein kinase homolog which regulates cell integrity and functions coordinately with the protein kinase C pathway. Mol. Cell. Biol., 16, 6752–6764.
9) Sugiura, R., Kita, A., Shimizu, Y., Shuntoh, H., Sio, S.O., & Kuno, T. (2003) Feedback regulation of MAPK signalling by an RNA-binding protein. Nature, 424, 961–965.
10) Satoh, R., Morita, T., Takada, H., Kita, A., Ishiwata, S., Doi, A., Hagihara, K., Taga, A., Matsumura, Y., Tohda, H., et al. (2009) Role of the RNA-binding protein Nrd1 and Pmk1 mitogen-activated protein kinase in the regulation of myosin mRNA stability in fission yeast. Mol. Biol. Cell, 20, 2473–2485.
11) Lee, E.K. (2012) Post-translational modifications of RNA-binding proteins and their roles in RNA granules. Curr. Protein Pept. Sci., 13, 331–336.
12) Ohn, T. & Anderson, P. (2010) The role of posttranslational modifications in the assembly of stress granules. Wiley Interdiscip. Rev. RNA, 1, 486–493.
13) Tsai, N.P., Ho, P.-C., & Wei, L.-N. (2008) Regulation of stress granule dynamics by Grb7 and FAK signalling pathway. EMBO J., 27, 715–726.
14) Wippich, F., Bodenmiller, B., Trajkovska, M.G., Wanka, S., Aebersold, R., & Pelkmans, L. (2013) Dual specificity kinase DYRK3 couples stress granule condensation/dissolution to mTORC1 signaling. Cell, 152, 791–805.
15) Hofmann, S., Kedersha, N., Anderson, P., & Ivanov, P. (2021) Molecular mechanisms of stress granule assembly and disassembly. Biochim. Biophys. Acta Mol. Cell Res., 1868, 118876.
16) Ohn, T., Kedersha, N., Hickman, T., Tisdale, S., & Anderson, P. (2008) A functional RNAi screen links O-GlcNAc modification of ribosomal proteins to stress granule and processing body assembly. Nat. Cell Biol., 10, 1224–1231.
17) Xie, X., Matsumoto, S., Endo, A., Fukushima, T., Kawahara, H., Saeki, Y., & Komada, M. (2018) Deubiquitylases USP5 and USP13 are recruited to and regulate heat-induced stress granules through their deubiquitylating activities. J. Cell Sci., 131, jcs210856.
18) Arimoto, K., Fukuda, H., Ohmi, S.I., Saito, H., & Takekawa, M. (2008) Formation of stress granules inhibits apoptosis by suppressing stress-responsive MAPK pathways. Nat. Cell Biol., 10, 1324–1332.
19) Kim, W.J., Back, S.H., Kim, V., Ryu, I., & Jang, S.K. (2005) Sequestration of TRAF2 into stress granules interrupts tumor necrosis factor signaling under stress conditions. Mol. Cell. Biol., 25, 2450–2462.
20) Takahara, T. & Maeda, T. (2012) Transient sequestration of TORC1 into stress granules during heat stress. Mol. Cell, 47, 242–252.
21) Thedieck, K., Holzwarth, B., Prentzell, M.T., Boehlke, C., Kläsener, K., Ruf, S., Sonntag, A.G., Maerz, L., Grellscheid, S.-N., Kremmer, E., et al. (2013) Inhibition of mTORC1 by astrin and stress granules prevents apoptosis in cancer cells. Cell, 154, 859–874.
22) Li, C., Fultz, M.E., & Wright, G.L. (2002) PKC-alpha shows variable patterns of translocation in response to different stimulatory agents. Acta Physiol. Scand., 174, 237–246.
23) Kobayashi, T., Winslow, S., Sunesson, L., Hellman, U., & Larsson, C. (2012) PKCα binds G3BP2 and regulates stress granule formation following cellular stress. PLoS One, 7, e35820.
24) Sugiura, R., Toda, T., Shuntoh, H., Yanagida, M., & Kuno, T. (1998) pmp1+, a suppressor of calcineurin deficiency, encodes a novel MAP kinase phosphatase in fission yeast. EMBO J., 17, 140–148.
25) Kanda, Y., Satoh, R., Matsumoto, S., Ikeda, C., Inutsuka, N., Hagihara, K., Matzno, S., Tsujimoto, S., Kita, A., & Sugiura, R. (2016) Skb5, an SH3 adaptor protein, regulates Pmk1 MAPK signaling by controlling the intracellular localization of the MAPKKK Mkh1. J. Cell Sci., 129, 3189–3202.
26) Hilliker, A., Gao, Z., Jankowsky, E., & Parker, R. (2011) The DEAD-box protein Ded1 modulates translation by the formation and resolution of an eIF4F-mRNA complex. Mol. Cell, 43, 962–972.
27) Zou, T., Rao, J.N., Liu, L., Xiao, L., Cui, Y.-H., Jiang, Z., Ouyang, M., Donahue, J., & Wang, J.-Y. (2012) Polyamines inhibit the assembly of stress granules in normal intestinal epithelial cells regulating apoptosis. Am. J. Physiol. Cell Physiol., 303, C102–C111.
28) Fournier, M.J., Gareau, C., & Mazroui, R. (2010) The chemotherapeutic agent bortezomib induces the formation of stress granules. Cancer Cell Int., 10, 12.
29) Shah, O.J., Wang, Z., & Hunter, T. (2004) Inappropriate activation of the TSC/Rheb/mTOR/S6K cassette induces IRS1/2 depletion, insulin resistance, and cell survival deficiencies. Curr. Biol., 14, 1650–1656.
30) Tsai, N.-P. & Wei, L.-N. (2010) RhoA/ROCK1 signaling regulates stress granule formation and apoptosis. Cell. Signal., 22, 668–675.
31) Timalsina, S., Matsuzaki, K.A., Kitamura, M., Xu, X., Wenzhe, Q., Yuasa, M.I., Kagechika, H., & Hata, Y. (2018) Chemical compounds that suppress hypoxia-induced stress granule formation enhance cancer drug sensitivity of human cervical cancer HeLa cells. J. Biochem., 164, 381–391.
32) Asadi, M.R., Moslehian, M.S., Sabaie, H., Poornabi, M., Ghasemi, E., Hassani, M., Hussen, B.M., Taheri, M., & Rezazadeh, M. (2021) Stress granules in the anti-cancer medications mechanism of action: A systematic scoping review. Front. Oncol., 11, 797549.
33) Grabocka, E. & Sagi, D.B. (2016) Mutant KRAS Enhances tumor cell fitness by upregulating stress granules. Cell, 167, 1803–1813.
34) Hu, X., Xia, K., Xiong, H., & Su, T. (2021) G3BP1 may serve as a potential biomarker of proliferation, apoptosis, and prognosis in oral squamous cell carcinoma. J. Oral Pathol. Med., 50, 995–1004.
35) Somasekharan, S.P., Naggar, A.E., Leprivier, G., Cheng, H., Hajee, S., Grunewald, T.G.P., Zhang, F., Ng, T., Delattre, O., Evdokimova, V., et al. (2015) YB-1 regulates stress granule formation and tumor progression by translationally activating G3BP1. J. Cell Biol., 208, 913–929.
36) Zheng, H., Zhan, Y., Zhang, Y., Liu, S., Lu, J., Yang, Y., Wen, Q., & Fan, S. (2019) Elevated expression of G3BP1 associates with YB1 and p-AKT and predicts poor prognosis in nonsmall cell lung cancer patients after surgical resection. Cancer Med., 8, 6894–6903.
著者紹介Author Profile
 杉浦 麗子(すぎうら れいこ)
杉浦 麗子(すぎうら れいこ)近畿大学薬学部教授.博士(医学).
略歴1992年神戸大学医学部卒業.92~94年レジデント(精神科,神経内科).96~2003年神戸大学大学院医学系研究科助手,准教授.2000年文部科学省在外研究員(英国王立癌研究所).04年より現職.
研究テーマと抱負分裂酵母モデル生物と遺伝学のパワーを最大限に生かした細胞内シグナル伝達経路制御機構の解明と創薬への応用.人とは違う視点から生まれるオリジナリティーある研究を楽しみたい.
ウェブサイトhttps://www.phar.kindai.ac.jp/genome/
趣味読書,音楽鑑賞,筋トレ,介護.